皕晟百科
ENCYCLOPEDIAS
|
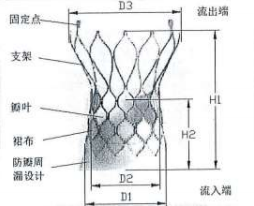
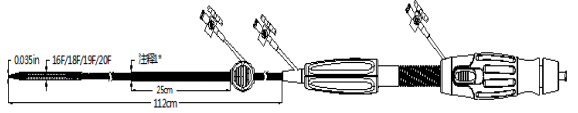
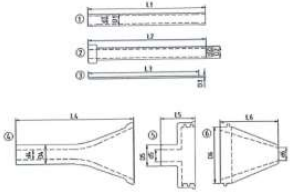
经导管主动脉瓣系统医疗器械产品注册技术审评报告医疗器械产品注册技术审评报告 产品中文名称:经导管主动脉瓣系统 产品管理类别:第三类 申请人名 称:沛嘉医疗科技(苏州)有限公司 国家药品监督管理局 医疗器械技术审评中心 目 录 基本信息...................................................................................................3 一、申请人名称.......................................................................................3 二、申请人住所.......................................................................................3 三、生产地址...........................................................................................3 技术审评概述...........................................................................................4 一、产品概述...........................................................................................4 二、临床前研究概述...............................................................................6 三、临床评价概述...................................................................................13 四、产品受益风险判定...........................................................................16 综合评价意见......................................................................................... 20 基本信息 一、申请人名称 沛嘉医疗科技(苏州)有限公司 二、申请人住所 中国(江苏)自由贸易试验区苏州片区苏州工业园区中 田巷 8 号 三、生产地址 江苏省苏州市苏州工业园区中田巷 8 号 3 楼和 1 楼 A 区 技术审评概述 一、产品概述 (一)产品结构及组成 经导管主动脉瓣系统由主动脉瓣、配套的输送器及安装 使用的压握装载系统组成。主动脉瓣由自扩张镍钛合金支架、 裙布、瓣叶及缝合线组成。瓣膜采用化学液体灭菌,输送器 和压握装载系统采用环氧乙烷灭菌。一次性使用。货架有效 期 2 年
图 1 主动脉瓣
图 2 输送器
图 3 压握装载系统 (二)产品适用范围 该产品适用于经心脏团队评估认为患需要接受主动脉 瓣置换但不适合接受常规外科手术置换瓣膜的重度主动脉 瓣钙化性狭窄患者。 (三)型号规格 表 1 主动脉瓣系统型号规格及各部件对应关系表
(四)作用机理 产品采用微创介入治疗方法,使用前通过压缩装载系统 将主动脉瓣装载进输送器内;使用时在医学影像设备的监控— 6 — 下,通过建立好的血管通路将输送器推送至预期位置,操作输送器手柄完成瓣膜的释放,通过人工主动脉瓣支架的径向 支撑力将患者自身的主动脉瓣膜植入并贴附在主动脉壁上, 人工主动脉瓣替代患者的自身主动脉瓣,构建正常的血流通道。 二、临床前研究概述 (一)产品性能研究 1.产品技术要求研究 技术要求研究项目如表 2 所示: 表 2 技术要求研究摘要
2.产品性能评价 产品性能评价包括:主动脉瓣的裙布破裂力、瓣叶拉伸 强度、瓣叶破裂力、外观、主动脉瓣基本尺寸、主动脉瓣支 架厚度、主动脉瓣瓣叶厚度、径向支撑力、慢性向外力、支 架相变点 Af、主动脉瓣轴向短缩率、主动脉瓣抗挤压性、支 架腐蚀敏感性、支架和瓣叶连接强度、支架和裙布连接强度、 瓣叶和裙布连接强度、主动脉瓣脉动流性能、主动脉瓣开合 状态、植入物抗位移性能、主动脉瓣静态前向流性、主动脉瓣稳态泄露性能、主动脉瓣耐久性能、支架疲劳性能、主动 脉瓣局部抗挤压性、热皱缩温度、孔隙率、渗漏量和长度变 化率。输送器的外观、尺寸、断裂力、导引导丝畅通性、连 接件(座)、无泄漏、耐腐蚀性、止血性能和水合性。压握 装载系统的外观和尺寸。主动脉瓣系统的压握装载性能、系 统排空性、系统柔顺性、系统推送力、系统追踪性、系统释 放准确性、系统释放时间、系统可回收性、系统回收后主动 脉瓣性能、输送器回撤性能、产品磁共振兼容性、射线可探 测性、系统释放扭矩、扭转性能和主动脉瓣与输送器连接强 度等性能进行了验证。 (二)生物相容性 该产品包括主动脉瓣、输送器和压握装载系统三个部分。 其中瓣膜为植入器械,与循环血液长期接触;输送器为外部 介入器械,与循环血液短期接触;压握装载系统与人体间接 接触。申请人按照 GB/T 16886 系列标准对所有部件分别进 行了生物相容性评价,产品的生物相容性风险可接受,具体评价项目详见表 3。 表 3 生物相容性评价项目表
(三)生物安全性 该产品的瓣膜部分采用了牛心包。申请人从原材料选取、原材料获取、原材料和供应商管控、生产过程管控、产品处 理工艺方法控制、质量体系保证等方面进行了论述,并参照标准 GB/T 16886.20 和动物源性医疗器械注册技术审查指导原则等要求对瓣膜的抗钙化,免疫原和病毒灭活的性能进行了验证,结果符合要求,相关生物安全性风险可控。 (四)灭菌 该产品包括主动脉瓣、输送器和压握装载系统三个部分。 其中主动脉瓣部分采用戊二醛液体化学灭菌方法,其余的部件均采用环氧乙烷灭菌,无菌状态提供。申请人提供了灭菌过程确认报告,保证 10-6无菌水平。输送器环氧乙烷残留量不应大于 10μg/g,压握装载系统环氧乙烷残留量不应大于4mg/套。输送器和压握装载系统的 ECH 残留量不应大于 9mg/ 套。 (五)产品有效期和包装 该产品包括主动脉瓣、输送器和压握装载系统三个部分。 产品有效期均为 2 年。申请人提供了货架有效期验证报告, 包括产品稳定性、包装完整性和运输模拟验证。 (六)动物研究 申请人开展了大动物实验研究以验证产品使用性能及 安全性。评价指标包括有效性指标(瓣膜及输送系统的急性 性能,瓣膜的短期、中期和长期血液动力学性能等)和安全 性指标(包括瓣膜的生物学反应等)。动物实验结果表明,产品达到预期设计要求。 三、临床评价概述 该临床试验主要针对可回收输送器及回收过程对瓣膜 的影响进行评价。该临床试验共计纳入 81 例受试者进行统 计分析,验证该产品的安全性及有效性。 主要有效性评价指标:30 天时复合事件发生率。 次要有效性评价指标:术后即刻器械成功率、手术成功 率、30 天心功能改善(NYHA 心功能分级)、患者术后生活质 量(EQ-5D)、产品性能评价。 安全性评价指标:手术即刻有无发生手术并发症、试验 期间的主要不良心脑血管事件(MACCEs)的发生率、试验期间主要不良瓣膜相关事件(MAVREs)的发生率、试验期间的 出血、急性肾损伤、血管并发症及其它 TAVR 相关并发症分析 结果、瓣膜功能。 临床结果: 本阶段共 8 家临床机构参与试验,纳入统计全分析集 (FAS)共 81 例,符合方案集(PPS)共 81 例。 81 例受试者中有 80 例使用了球囊预扩张,在植入的瓣 膜中,有 38 个瓣膜在植入后使用了球囊扩张。共有 27 枚瓣 膜使用了输送器的可回收功能,占比 33.3%,回收性能优良 率为 100.0%。回收功能的设计提高了手术容错率,对于释放 后位置不理想,血流动力学指标不满意,提供了重新定位, 再次释放,术中立刻纠正不良情况的可能,增加手术成功率。 主要有效性评价指标结果: 81 例受试者中,有 14 例在术后 30 天内发生主要终点的 事件,发生率为 17.3%,小于预设的目标值,研究假设成立。 次要有效性评价指标结果:
安全性评价指标数据分析结果: 手术即刻发生的手术并发症比率为 8.6%。 试验期间累计 MACCEs 发生率为 49.4%。 试验期间累计 MAVREs 发生率为 14.8%。 出血并发症发生率为 3.8%;无急性肾损伤并发症发生; 血管并发症发生率为 15.2%;其他 TAVR 相关并发症发生率为 2.5%。 术前 CT 显示,三叶式主动脉瓣占比 53.1%,二叶式主动 脉瓣占比 46.9%;术前超声显示合并主动瓣返流占比 92.6%; 合并二尖瓣反流占比 93.8%;合并三尖瓣反流占比 87.7%。 术后即刻超声心动图显示血液动力学持续改善,平均跨 主动脉瓣压力差和跨主动脉瓣最大血流速度显著降低,左室 射血分数上升,主动脉瓣瓣口面积显著增大,均为无人工主动脉瓣返流。 术后 30 天随访开展了超声心动图检查,未发现人工主 动瓣狭窄、人工主动脉瓣移位及人工主动脉瓣脱落。 经导管主动脉瓣系统在临床试验中显著降低死亡率,提高患者生存质量,改善心功能,但可能伴随卒中、冠脉闭塞、心律失常、血管并发症等风险。根据申请人提供的申报资料, 经综合评价,认为该产品为患者带来的受益远大于风险。 四、产品受益风险判定 申请人参照《YY/T 0316-2016 医疗器械风险管理对医 疗器械的应用》,对该产品进行风险分析。对目前已知及可预 测风险采取了风险控制措施,经综合评价,在目前认知水平 上,认为该产品上市带来的获益/受益大于风险,为保证用械安全,需在说明书中提示以下信息: (一)警示及注意事项 1.通用注意事项: • 手术必须在具备主动脉瓣急诊手术能力的环境实施。 • 瓣膜植入的手术只有经培训合格的、有资质的医师才 能进行。 • 瓣膜只能与配套的输送器、压握装载系统配合使用。 •出现以下任何情况,产品都不能继续使用:ⅰ产品过期; ⅱ掉落、损伤或任何的不当处理;ⅲ任何会导致患者出现并 发症的输送器或附件的机械故障。 • 产品注意事项 • 本产品为一次性使用,禁止重复使用、处理及任 何形式的灭菌。对产品的重复使用、处理、灭菌可能破坏产 品结构的完整性,使产品污染的风险,这可能导致患者的伤 害、疾病或死亡。 • 使用有效期内的产品,并在干燥阴凉处储存。 • 切勿将产品与任何棉制品接触。 • 切勿将产品与任何有机溶剂接触,如酒精。 • 切勿将瓣膜与保存液和漂洗液(无菌生理盐水) 之外的溶液接触。 • 切勿应用抗生素或任何其他物质于瓣膜、瓣膜的 保存液或漂洗液中。 • 出现以下任何情况,切勿继续使用瓣膜:ⅰ保存 液未完全浸没瓣膜;ⅱ温度指示标签已激活/变色;ⅲ产品包 装标签不一致;ⅳ任何包装损伤。 • 瓣膜及保存液为无菌状态。 • 接触瓣膜保存液会引起皮肤、眼睛、鼻子和喉咙 的刺激。 • 防止瓣膜干燥,通过冲洗或浸泡保持瓣膜瓣叶湿 润。 • 切勿尝试以任何形式修复已损伤的瓣膜的瓣叶。 • 切勿对瓣膜的瓣叶施加超过压握、装载和植入限 度所需的压力和形变。切勿使用镊子碰触瓣膜的瓣叶。 • 压握装载瓣膜前,需按照漂洗步骤对其进行漂洗。 • 确保瓣膜在装载完成后至进入病人体内前,装载 瓣膜的输送器导管远端浸没在无菌盐水中。 • 产品不建议多次装载过程,且装载后的压缩时间 不建议超过 20min。 • 切勿向输送器的导管中引入空气。 • 输送器导管的损坏可能由于强力操作。从包装中 取出输送器时应避免导管打折。 2.使用过程注意事项: • 植入瓣膜的尺寸必须与患者的解剖尺寸相匹配。 • 如在放置瓣膜过程中遇到明显异常阻力,或无法放置, 则撤出,重新更换另一套系统。 • 在植入过程中确保在导丝牵引的情况下推送输送器; 禁止从输送器中取出导引导丝。系统使用过程中不推荐扭转。 • 释放期间,只要瓣膜未接触自体瓣环,则可以通过继续 手柄前推或后撤,用于调整其释放位置;一旦接触到自体瓣环,则禁止逆方向推进瓣膜;如必要,可在其释放≤2/3 长 度前,通过小心后撤来调整其释放位置。 • 一旦瓣膜释放完成,不建议调整其位置(如使用一个圈 套器和/或镊子)。 • 撤出输送器前应确认外管远端(瓣膜装载部位)已通过 锥形头(Tip)闭合。如果在撤出输送器过程中遇到阻力,禁止强行撤出。 3.磁共振兼容性(MRI): MRI 只有在特定条件下可以使用。非临床的测试表明瓣 膜可以在下列条件下安全的进行 MRI 扫描:静态磁场强度为 1.5T 或 3T,测试位置空间磁场梯度不大于 601Gauss/cm (6.010T/m),最大全身平均比吸收率约(SAR)为 3.6W/kg 或更低,在正常工作模式下,持续 20 分钟的扫描。 根据非临床测试,在磁场强度为 3T,以及最大全身平均 比吸收率约(SAR)为 3.6W/kg 的条件下,进行 20 分钟的核磁共振扫描(MRI)时,瓣膜产生的局部升温不超过 4.0℃, 瓣膜在 3T 磁场环境下扫描时,当所要观察区域接近或在瓣 膜植入部位时,伪影可能产生影响。尚未对产品进行磁场强 度大于 3T 的非临床测试,产品情况未知。 (二)禁忌症 产品禁止用于有任何以下情况的患者: • 对镍钛合金、牛制品过敏 • 左心室内血栓 • 左心室流出道梗阻 • 纠治 AS 后的预期寿命小于 12 个月 • 入径或主动脉根部解剖形态上不适合 TAVR(如冠状动 脉堵塞风险高) 综合评价意见 本申报产品属于 创新医疗器械(创新编号: CQTS2000096)。申请人的注册申报资料符合现行要求,依据 《医疗器械监督管理条例》(国务院令第 680 号)、《医疗器械 注册管理办法》(国家食品药品管理总局令 2014 年第 4 号) 等相关医疗器械法规与配套规章,经系统评价后,建议准予 注册。 鉴于该产品远期安全性、有效性尚需进一步追踪,建议 申请人在注册后进行以下工作:1.对上市前临床试验入组的 患者继续进行随访,评估产品远期安全性和有效性。2.为进 一步观察产品在真实世界中远期安全性和有效性,上市后开 展注册研究,对植入产品的患者进行长期跟踪随访。随访内 容应包括但不仅限于:瓣膜失功情况,因瓣膜问题导致的再 手术情况,与瓣膜相关的死亡、出血及栓塞事件发生情况。 定期形成临床随访报告和随访数据统计分析报告。3.如果出 现重大的安全性问题,应按照有关不良事件监测规定及时上 报相关部门。 2021 年 6 月 17 日 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||