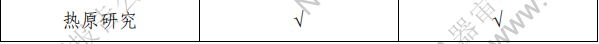皕晟百科
ENCYCLOPEDIAS
|
球囊扩张血管内覆膜支架系统医疗器械产品注册技术审评报告医疗器械产品注册技术审评报告 产品中文名称:球囊扩张血管内覆膜支架系统 产品英文(原文)名称:GORE® VIABAHN® VBX Balloon Expandable Endoprosthesis 产品管理类别 :第三类 申请人名 称:W.L. Gore & Associates, Inc. 戈尔及同仁有限公司 国家药品监督管理局 医疗器械技术审评中心 目 录 基本信息.....................................................................................................3 一、申请人名称.........................................................................................3 二、申请人住所.........................................................................................3 三、生产地址.............................................................................................3 技术审评概述.............................................................................................4 一、产品概述.............................................................................................4 二、临床前研究概述 ................................................................................6 三、临床评价概述...................................................................................11 四、产品受益风判定 ..............................................................................14 综合评价意见...........................................................................................20 基本信息 一、申请人名称 戈尔及同仁有限公司 W.L. Gore & Associates, Inc. 二、申请人住所 1505 N. Fourth Street, Flagstaff, Arizona 86004, USA 三、生产地址 1505 North Fourth Street, Flagstaff, Arizona 86004, USA 3250 W. Kiltie Lane, Flagstaff, Arizona, 86005, USA 技术审评概述 一、产品概述 (一)产品结构及组成 产品由血管内覆膜支架以及输送系统两部分组成,其中血 管内覆膜支架预装在 PTA 球囊上。血管内覆膜支架包含 316L 不锈钢环和覆膜,覆膜由 ePTFE 以及 FEP 组成。血管内覆膜支 架带有肝素涂层。一次性使用,环氧乙烷灭菌。 (二)产品适用范围 本产品适用于治疗发生于髂总动脉和髂外动脉的原发闭塞 性病变,参考血管直径范围为 5mm~13mm,最大病变长度为 110mm,包括主髂动脉分叉部位的原发闭塞性病变。 (三)型号/规格 表 1 产品型号规格
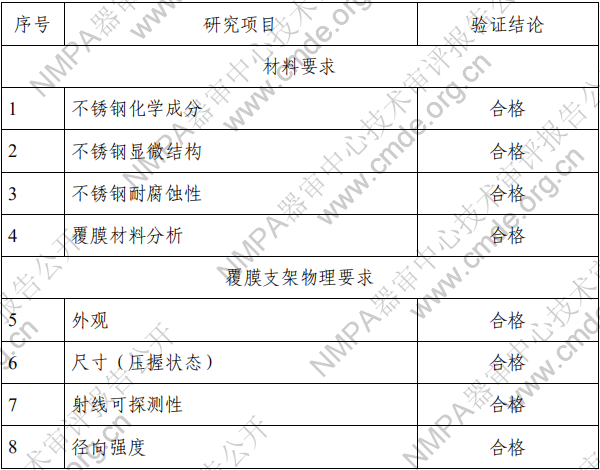
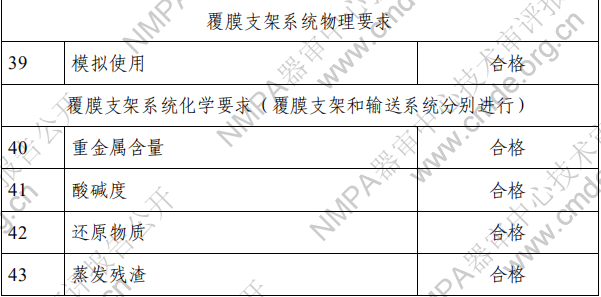
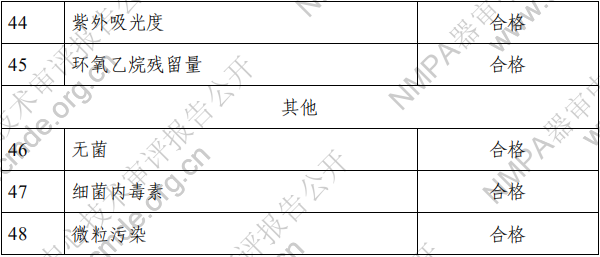
(四)工作原理 对于植入手术过程,医生通过导丝获得进入目标位置的通 道。通过充盈 PTA 球囊导管来预扩张目标病变,并进行血管造 影测量以选择合适尺寸的支架。球扩覆膜支架通过导丝到达目标位置并置于目标病变处。通过充盈球囊至所需的压力使得覆 膜支架从输送系统上展开。当支架完全展开和固定时,支架支 撑目标血管。输送系统上的球囊卸压撤回,或可用于支架后扩张。 二、临床前研究概述 (一)产品性能研究 1.产品技术要求研究 技术要求研究项目如下表 2 所示。 表 2 技术要求研究摘要
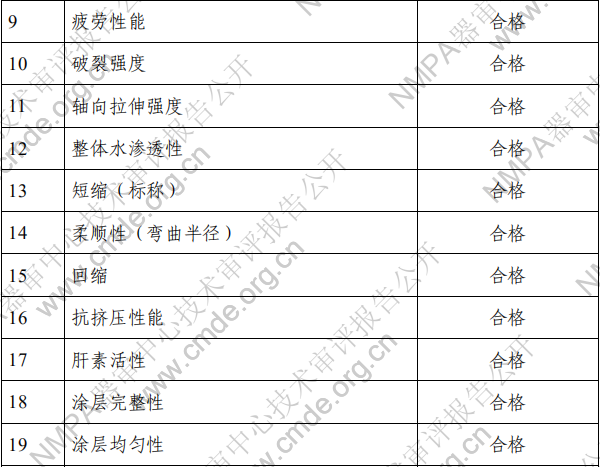
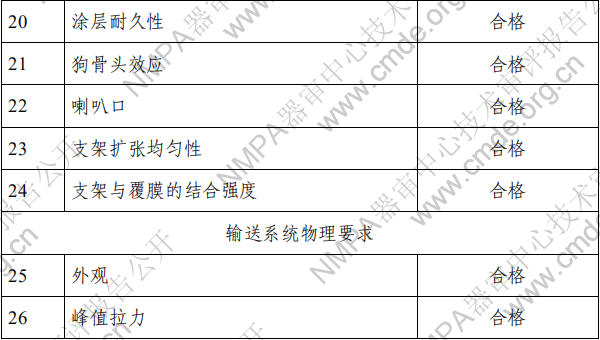
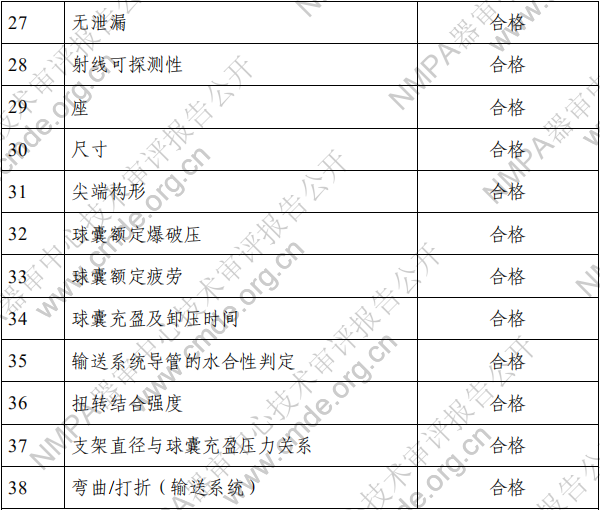
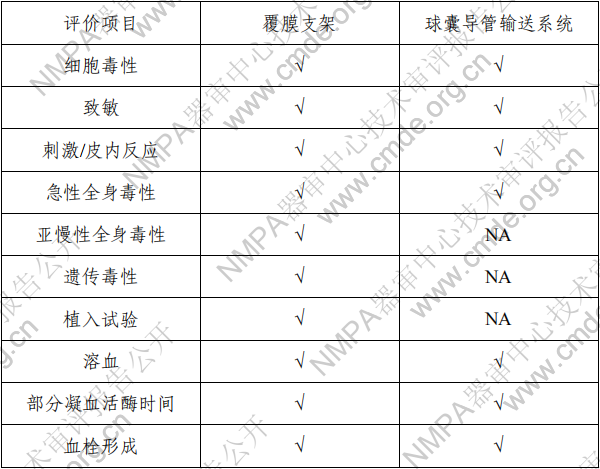
2.产品性能评价 产品的性能评价项目包括覆膜支架系统的尺寸(轮廓、压 握支架长度、导管有效长度、导管内腔直径、支架壁厚和导管 轴外径、狗骨头效应)、模拟使用(辅件兼容性、导管液体泄漏、 贴壁性、输送系统柔韧性/扭结、抗位移性、喇叭口效应、推送 性、回撤过程中支架移位、支架保留、跟踪性、回撤后输送系 统目视检查以及展开支架目视检查)、破裂强度、(脉动疲劳后) 耐腐蚀性能、抗挤压性能、回缩、短缩、支架扩张均匀性、弯 曲半径、轴向拉伸强度、机械完整性、整体水渗透性、径向强 度、射线可探测性、疲劳性能、有限元分析、肝素活性、涂层 完整性、涂层均匀性、涂层耐久性、支架与覆膜结合强度、MRI 兼容性、微粒、导管抗拉强度、导管扭转结合强度、导管无泄 漏(抽吸)、球囊充盈及卸压时间、球囊额定爆破压、球囊疲劳、 支架直径与球囊充盈压力的顺应性曲线等项目的研究。 (二)生物相容性 球囊扩张血管内覆膜支架系统包含覆膜支架和球囊导管输 送系统两部分。覆膜支架为植入器械,与循环血液长期接触; 球囊导管输送系统为外部接入器械,与循环血液短期接触。根 据 GB/T 16886.1-2011 标准内容,基于产品的适用范围及接触人 体的性质,对覆膜支架及球囊导管输送系统分别进行了生物相 容性评价。结果表明产品的生物相容性风险可接受。具体评价 的项目请见表 3。 表 3 生物相容性评价项目表
√表示该项目经过评价;NA 表示该项目不适用。 (三)灭菌 该产品采用环氧乙烷灭菌,无菌状态提供。申请人提供了 灭菌确认报告,证明无菌保证水平为 10-6 (四)产品有效期和包装 产品货架有效期为 3 年,申请人提供了货架有效期验证报 告,验证试验为加速稳定性试验和实时稳定性试验,包括产品 自身稳定性和包装稳定性研究。 (五)动物研究 申请人在三种不同的动物模型(猪、羊和犬)上对该器械 进行了动物研究。共提交 7 项临床前动物实验,分别在急性及 慢性模型进行相关评价,并设立对照组。针对输送系统特性、 植入器械通畅性、单个及重叠器械适用情况进行评价。动物实 验结果表明,产品达到预期设计要求。 三、临床评价概述 申请人按照《接受医疗器械境外临床试验数据技术指导原 则》(2018 年第 13 号)提交了相关境外临床试验数据。 (一)研究设计 球囊扩张血管内覆膜支架系统(以下简称:VBX)上市前临床研究为前瞻性、多中心、非随机、单臂临床研究,以验证 VBX 产品的安全性和有效性。研究在 27 家境外研究机构中进行。研究纳入意向性分析(简称 ITT)人群为 140 名受试者,纳入符 合方案(简称 PP)人群为 134 名受试者。 临床试验的主要研究目的是评估 VBX 在治疗原发性或再 狭窄性髂总动脉和/或髂外动脉闭塞性病变中的安全性和有效 性。 随访时间:30 天、9 个月、12 个月、24 个月和 36 个月 研究的主要终点: 主要不良事件(MAE)的复合终点,定义如下: • 30 天内器械或手术相关的死亡 • 30 天内心肌梗塞(MI) • 9 个月内靶病变血运重建(TLR) • 9 个月内大截肢手术 研究的次要终点: • 即刻手术成功 • 30 天临床成功 • 一期通畅率 • 辅助一期通畅率 • 二期通畅率 • 免于靶病变血运重建(TLR) • 免于临床驱动的靶病变血运重建(TLR) • 免于靶血管血运重建(TVR) • 免于临床驱动的靶血管血运重建(TVR) • 从基线开始 Rutherford 分级的变化 • 静息踝肱指数(ABI)或趾肱指数(TBI)的变化 • 患者功能状态的变化 (二)研究结果 研究所观察到的 MAE 发生率为 4.3%(ITT),低于所预设 的性能目标(17%)。即刻手术成功 97%,30 天临床成功 90.8%, 一期通畅率 9/12 个月分别为 96.9%、94.5%,辅助一期通畅率 9/12 个月分别为 99.5%、99.0%,二期通畅率 9/12 个月分别为 99.5%、99.5%,免于靶病变血运重建(TLR)9/12/24/36 个月分 别为 97.4%、95.2%、92.3%、91.2%,免于临床驱动的靶病变血 运重建(TLR)9/12/24/36 个月分别为 98.9%、98.1%、98.1%、 98.1%,免于靶血管血运重建(TVR)9/12/24/36 个月分别为 97.6%、95.3%、92.4%、91.4%,免于临床驱动的靶血管血运重 建(TVR)98.1%、98.1%、97.7%、97.1%、,Rutherford 分级的 变化相对于术前改善至少一个分级 9/12/24/36 个月分别为 94.1%、94.7%、94.1%、92.1%,静息踝肱指数(ABI)和趾肱指数(TBI)30 天/9/12/24/36 个月变化平均改善为 0.19 和 0.05、 0.19 和 0.08、0.19 和 0.08、0.17 和 0.06、0.17 和 0.08,患者功 能状态(EQ-5D)的变化较术前改善或保持不变 30 天/9/12/24/36 个月为 93.0%、85.0%、87.7%、87.1%、86.5%。申请人提供了 申报产品在日本上市后的临床经验数据作为辅助性证据,共纳 入 17 名患者,最长随访时间为 12 个月,数据显示 MAE 发生率 为 0,手术成功率、一期通畅率、二期通畅率、免于靶病变血运 重建(TLR)均为 100%。 (三)结论 上述报告中数据显示 VBX 在治疗发生于髂总动脉和髂外 动脉的原发闭塞性病变的安全有效性基本可接受。 四、产品受益风险判定 根据风险管理相关规定,对产品进行了风险受益分析,识 别出产品的潜在风险,对单个风险以及单个风险的组合的影响 进行了评估,采取了相应的风险控制措施并对风险控制措施的 有效性进行了验证。经评估,与产品的受益相比,产品整体剩 余风险可接受。 根据申请人提供的申报资料,经综合评价,在目前认知 水平上,认为该产品的上市为适用人群带来的受益大于风险。但为保证用械安全,需在说明书中提示以下信息: (一)产品适用范围 本产品适用于治疗发生于髂总动脉和髂外动脉的原发闭塞 性病变,参考血管直径范围为 5mm~13mm,最大病变长度为 110mm,包括主髂动脉分叉部位的原发闭塞性病变。 (二)警告、注意事项、禁忌症 1.警告 • 请勿将球囊扩张血管内覆膜支架系统用于治疗不适宜施 行保肢手术的病变。 • 请勿将球囊扩张血管内覆膜支架系统用于已知对肝素有 超敏反应的患者,包括曾有 II 型 HIT 发病史的患者。任何血管 手术都存在发生 HIT 的可能性。II 型 HIT 在接受数日肝素施用 的血管患者中的发病率极低。如果诊断出 II 型 HIT,应采用针 对此病症的现有治疗方法,包括立即中止全身肝素施用。如果 症状持续存在,或者患者的健康状况明显转差,主治医师可酌 情考虑采用其他药物或外科手术,包括血管结扎或支架移除。 • 应格外小心以确保在导入支架前选择尺寸恰当的支架、 兼容的导引鞘和导丝。必须准确测量原生血管的尺寸,切勿估 计。 • 请勿超过最大额定爆破压。超过此压力会增加球囊破裂 和血管损伤的潜在可能。 • 请勿超过说明书中表 1 和表 2 所列的支架后扩张允许达 到的最大直径。 • 为了降低血管受损的可能,最终支架内径(如尺寸选择 表中所示)应近似于狭窄部位近端和远端的血管直径。过度撑 开动脉可能会导致破裂和危及生命的出血。 • 仅使用稀释造影剂充盈球囊(通常是体积比为 50/50 的造 影剂和普通生理盐水的混合物)。切勿使用空气或任何气体类介 质充盈球囊。 • 请勿从球囊输送系统上取下支架。不得将球囊扩张血管 内覆膜支架取下并安装到另一个球囊导管上进行展开。仅可采 用原装输送系统展开支架。 • 请勿使用扭结的导引鞘。扭结的导引鞘可能会增大将支 架推送到目标位置所需的力。 • 如果没有适当尺寸的导丝和透视引导,请勿尝试释放支 架或操作输送系统。 • 在展开支架前,通过高分辨率透视检查确保支架在定位 过程中没有被损坏、部分释放或移位。如果已损坏、部分释放 或移位,请勿展开该支架。 • 除非球囊已完全回缩,否则请勿在已释放的支架腔内尝 试回撤球囊导管或调整其位置。 • 一旦球囊扩张血管内覆膜支架完全导入,请勿将该支架 回撤至导引鞘内。将球囊扩张血管内覆膜支架回撤至导引鞘内 会导致支架移位和/或损坏、过早展开、展开失败和/或导管分离。 如果在展开前须将其取出,将球囊扩张血管内覆膜支架回撤至 导引鞘附近,但不要进入导引鞘内。接着即可先后取出球囊扩 张血管内覆膜支架系统和导引鞘。取出后,请勿重复使用该球 囊扩张血管内覆膜支架系统或导引鞘。 • 如果支架不小心释放、部分释放、未能释放或者支架移 位,可能需要手术干预。 • 与所有球囊扩张支架一样,将球囊扩张血管内覆膜支架 置入易受严重外部压迫的血管,可能会导致该支架受到永久挤 压。 • 球囊扩张血管内覆膜支架不适用于冠状动脉、冠状动脉 旁路人工血管、冠状窦或颈动脉。 2.注意事项 • 球囊扩张血管内覆膜支架仅供一次性使用。Gore 没有关 于重复使用本支架的数据。重复使用可能造成支架失效或手术 并发症,包括支架受损、支架生物相容性降低和支架污染。重 复使用可能造成感染、严重伤害或患者死亡。 • 如果无菌包装破损或球囊扩张血管内覆膜支架系统损坏,请勿使用该器械。 • 请勿在超过标示的“使用期限”(有效期限)后,使用球囊 扩张血管内覆膜支架系统。 • 请勿对球囊扩张血管内覆膜支架系统进行再次灭菌。 • 仅可由接受过血管腔内技术培训的医师使用球囊扩张血 管内覆膜支架系统。 • 遵循与球囊扩张血管内覆膜支架系统配合使用的所有配 件随附的《产品说明书》。 • 应在置入球囊扩张血管内覆膜支架之前和之后给予抗血 小板药物。如果需要给予有效的抗凝治疗,该治疗应维持在医 师认为合适的剂量下进行。球囊扩张血管内覆膜支架表面带有 的肝素,并非用以替代外科医生所选的术中或术后抗凝血方案。 • 按照《产品说明书》中的指导准备预装的支架系统。如 球囊中有大量气体可能会导致难以展开支架和回缩球囊。 • 请勿尝试手动取下或调节输送球囊导管上的支架。 • 务必在透视引导下进行球囊扩张血管内覆膜支架输送系 统的体内操作。除非球囊在负压下完全回缩,否则不要推送或 回撤导管。 • 球囊扩张血管内覆膜支架系统的设计初衷并非为了与电 动注射系统配合使用。快速充盈会导致球囊导管损坏。建议使用压力监测装置,以防压力过大。 3.禁忌症 请勿将球囊扩张血管内覆膜支架系统用于已知对肝素有超 敏反应的患者,包括曾有Ⅱ型肝素诱导性血小板减少症(HIT)发 病史的患者。 综合评价意见 该申报产品属按照《创新医疗器械特别审批程序(试行)》 审批项目,编号 CQTS1700186。申请人的注册申报资料符合现 行要求,依据《医疗器械监督管理条例》(国务院令第 680 号)、 《医疗器械注册管理办法》(原国家食品药品监督管理总局令 2014 年第 4 号)等相关医疗器械法规与配套规章,经系统评价 后,建议准予注册。 2021 年 10 月 15 日 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||