皕晟百科
ENCYCLOPEDIAS
|
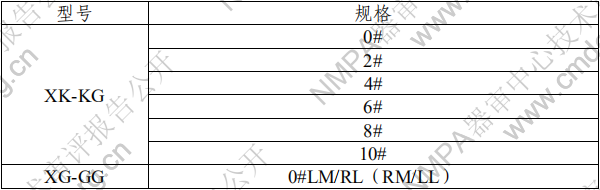
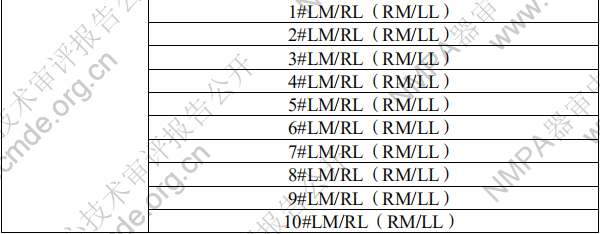
单髁膝关节假体医疗器械产品注册技术审评报告医疗器械产品注册技术审评报告 产品中文名称:单髁膝关节假体 产品管理类别:第三类 申请人名 称:北京市春立正达医疗器械股份有限公司 国家药品监督管理局 医疗器械技术审评中心 目 录 基本信息.........................................................................................................3 一、申请人名称.............................................................................................3 二、申请人住所.............................................................................................3 三、生产地址.................................................................................................3 技术审评概述.................................................................................................4 一、产品概述.................................................................................................4 二、临床前研究概述.....................................................................................6 三、临床评价概述.........................................................................................8 四、产品受益风险判定.................................................................................9 综合评价意见...............................................................................................13 基本信息 一、申请人名称 北京市春立正达医疗器械股份有限公司 二、申请人住所 北京市通州区通州经济开发区南区鑫觅西二路 10 号 三、生产地址 北京市通州区通州经济开发区南区鑫觅西二路 10 号 技术审评概述 一、产品概述 (一)产品结构及组成 该产品单髁膝关节假体由股骨髁和组配式胫骨平台组成, 组配式胫骨平台由胫骨平台垫和胫骨平台托组成。其中股骨髁 和组配式胫骨平台托由符合 YY 0117.3 标准规定的铸造钴铬钼 合金材料制成,组配式胫骨平台垫由符合 GB/T 19701.2 标准规 定的 2 型超高分子量聚乙烯材料制成,胫骨平台垫中的显影针 由符合 GB/T 13810 标准规定的 TC4 钛合金材料制成。灭菌包 装,辐照灭菌,灭菌有效期 5 年。 (二)产品适用范围 该产品与骨水泥配合使用,适用于膝关节单侧髁置换。 (三)型号/规格 表 1 股骨髁型号规格
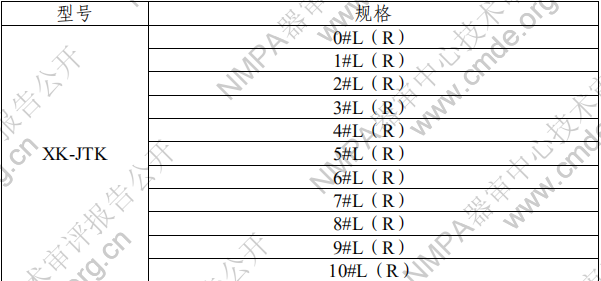
表 2 胫骨平台垫型号规格
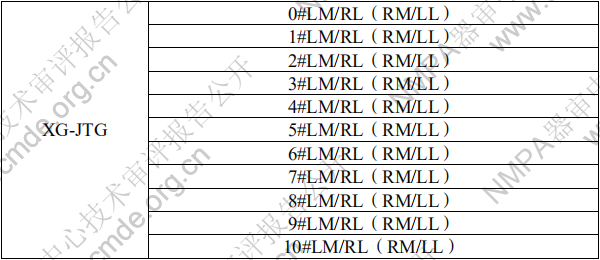
表 3 胫骨平台托型号规格
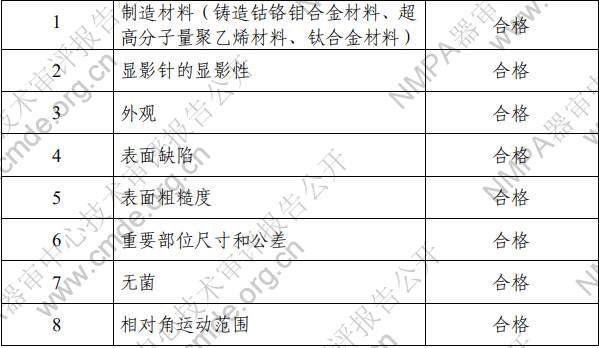
(四)工作原理 该产品针对膝关节病变的一侧(内侧或外侧),手术去除病 损的关节面(前后交叉韧带和侧副韧带保留),以单髁膝关节假 体代替病变部位,其中胫骨平台假体用骨水泥固定于胫骨近端 一侧,股骨髁假体用骨水泥固定于股骨远端一侧,使得股骨髁 假体与胫骨平台垫形成关节面,达到重建膝关节生理运动的目 的。 二、临床前研究概述 (一)产品性能研究 1.产品技术要求研究 技术要求研究项目如表 4 所示。 表 4 产品技术要求摘要
2.产品性能评价 产品性能评价包括:单髁膝关节接触面积和接触应力、股 骨髁的疲劳性能、胫骨托的疲劳性能、胫骨衬垫与胫骨托的锁 合强度、胫骨托与骨水泥固定强度、超高分子量聚乙烯材料的 老化前后性能稳定性、胫骨平台垫和胫骨平台托微动磨损试验、 单髁膝关节磨损性能、单髁膝关节活动度研究。 (二)生物相容性 该产品包括股骨髁和组配式胫骨平台组成,其中组配式胫 骨平台由胫骨平台垫和胫骨平台托组成,为植入器械,与骨长 期接触。申请人按照 GB/T 16886.1《医疗器械生物学评价 第 1 部分:风险管理过程中的评价与试验》的要求进行了生物学评价,经评价,申报产品采用符合国家标准或行业标准中规定的外科 植入物用材料,其中股骨髁和组配式胫骨平台托采用符合 YY 0117.3 标准规定的铸造钴铬钼合金材料,组配式胫骨平台垫采 用符合 GB/T 19701.2 标准规定的 2 型超高分子量聚乙烯材料, 胫骨平台垫中的显影针采用符合 GB/T 13810 标准规定的 TC4 钛合金材料,在产品生产加工过程中没有引入或导致新的生物 学风险,产品的生物相容性风险可接受。 (三)灭菌 该产品包括股骨髁和组配式胫骨平台组成,其中组配式胫 骨平台由胫骨平台垫和胫骨平台托组成,采用辐照灭菌方式灭 菌,无菌状态提供。申请人提供了产品辐照灭菌确认报告,保 证 10-6无菌水平。 (四)产品有效期和包装 该产品包括股骨髁和组配式胫骨平台组成,其中组配式胫 骨平台由胫骨平台垫和胫骨平台托组成,产品有效期为 5 年, 申请人提供了产品货架有效期验证报告,包括产品稳定性、包 装完整性和运输模拟验证资料。 三、临床评价概述 申请人采用同品种比对路径开展临床评价,选取已上市产 品作为同品种产品,按照《医疗器械临床评价技术指导原则》要求提交了临床评价资料,证明申报产品与同品种医疗器械基 本等同,对于差异部分提交了力学性能比对等支持性资料,证 明差异不影响临床的的安全有效性。 四、产品受益风险判定 申请人参照《YY/T 0316-2016 医疗器械风险管理对医疗器 械的应用》,对该产品进行风险分析。对目前已知及可预测风 险采取了风险控制措施,经综合评价,在目前认知水平上,认 为该产品上市带来的受益大于风险,为保证用械安全,需在说明 书中提示以下信息: (一)警示及注意事项 1.注意事项 (1)手术医生应熟练掌握所操作的器械和产品,并与专用器 械配套使用; (2)产品包装破损后不得使用。无菌包装的植入物术前任 意一层包装破损都视为有菌,不得作为无菌产品使用; (3)注意识别灭菌标识:无菌包装的植入物有γ射线灭菌 后的红色标识,灭菌有效期为 5 年; (4)为每位患者选取适合规格尺寸、形状、设计的植入物; (5)术前准备不充分不得进行手术; (6)应在术后定期做 X 线检查,植入物有无位置变化、弯曲、松动、断裂现象和未愈合现象; (7)术后不得从事过重的体力劳动或承受过大的冲击,不 合作的患者应适当限制其活动; (8)术前或术中发现产品有划痕、凹陷等缺陷时不应使用; (9)要病人及其家属清楚术后并发症和有可能产生的副作 用; (10)如果植入物出现断裂、移位、骨折或松动、感染或骨 损失应考虑取出植入物; (11)固定后可能会取出任何其它同时使用的内植入物; (12)本产品严禁二次使用; (13)应当纠正明显的固定屈曲畸形; (14)适用髓内工具或/和水泥挤压可导致脂肪栓塞风险增 加。考虑股骨或胫骨排气; (15)在同时实施对侧膝关节手术时,应将大腿绑带释放 10 分钟以降低可能发生的肺损伤; (16)产品由γ射线灭菌,超高分子量聚乙烯产品灭菌累计 剂量不超过 40kGy;术前任意一层包装损坏都视为有菌,不得 使用,一经发现应退回生产单位; 2.警示 (1)骨科内固定植入物产品是高风险性产品,使用不当会有损健康并有可能危及人身安全,造成严重后果。请医师务必 认真阅读和执行本说明书及骨科专业的规定,并且在手术前须 将本说明书及注意事项通知病人及病人家属,确认有关事项已 被告知和认可;本产品不得二次使用,不同类型材料的产品不 能混用,请勿与其他厂家产品混用。 (2)本产品尚未在磁共振(MRI)环境下对该产品的温升、移 位状况及伪影进行测试评估。因此,在产品植入人体后,在进 行诸如 MRI、CT 等影像检查时,需要对检查设备及使用人进行 相关检查与风险评估。 (二)禁忌症 1.整体或局部的急性或潜在性感染者; 2.骨质特别疏松、骨质不良、股骨或胫骨表面骨量不足、骨 骼发育不全者; 3.过于肥胖者(体重指数 BMI>30); 4.妨碍安装假体稳定性的侧面及前后交叉韧带的机能不全; 5.因其他疾病影响术后的功能者; 6.可影响骨形成的代谢性疾病; 7.软骨病或对侧关节囊关节软骨损伤; 8.X 光检查明显表现为关节破坏、骨质流失或骨吸收的快速 进行性疾病; 9.血管功能不全、肌肉萎缩或神经肌肉疾病; 10.内翻/外翻畸形超过 15 度; 11.对材料有过敏反应; 12.活动平台单髁膝关节假体(XK 型)用于膝关节外侧间 室置换。 综合评价意见 本申报产品属于创新医疗器械(创新编号:CQTS1700268)。 申请人的注册申报资料符合现行要求,依据《医疗器械监督管 理条例》(国务院令第 680 号)、《医疗器械注册管理办法》(国 家食品药品管理总局令 2014 年第 4 号)等相关医疗器械法规与 配套规章,经系统评价后,建议准予注册。 2021 年 8 月 3 日 |