皕晟百科
ENCYCLOPEDIAS
|
【技术审评报告】IFI44L 基因甲基化检测试剂盒(PCR-熔解曲线法)受理号: CSZ2300138
体外诊断试剂产品注册技术审评报告
产品中文名称: IFI44L 基因甲基化检测试剂盒(PCR-熔解曲线法) 产品管理类别:第三类 申 请 人 名 称:深圳市赛尔生物技术有限公司
国家药品监督管理局 医疗器械技术审评中心
目 录 基本信息 3 一、申请人名称 3 二、申请人住所 3 三、生产地址 3 技术审评概述 4 一、产品概述 4 二、临床前研究概述 5 三、临床评价概述 9 四、产品受益风险判定 10 综合评价意见 12
一、申请人名称 深圳市赛尔生物技术有限公司 二、申请人住所 深圳市宝安区西乡街道鹤洲恒丰工业城 B6 栋 201A 三、生产地址 深圳市宝安区西乡街道鹤洲恒丰工业城 B6 栋 201A
一、产品概述 (一)产品主要组成成分 试剂盒的主要组成成分见下表:
注:同一组分不同批号不能混用。 (二) 产品预期用途 本试剂盒用于体外定性检测人全血样本中的 IFI44L(干扰素诱导蛋 白 44L)基因启动子区域 DNA 甲基化水平。 本产品临床上联合其它实验室指标,用于系统性红斑狼疮的辅助诊 断。
- 4 -
20 测试/盒、 40 测试/盒。 (四) 产品检验原理 本产品原理包括两个步骤: 步骤Ⅰ, 用试剂盒 A 将提取的人全血基因组 DNA 进行重亚硫酸 盐处理,DNA 双链中未甲基化的胞嘧啶脱氨形成尿嘧啶,而甲基化的 胞嘧啶则保持不变。 步骤Ⅱ, 将重亚硫酸盐转化后的 DNA(Bis-DNA)做 PCR 扩增及 熔解曲线分析。本试剂盒 B 中含有甲基化特异性引物和饱和荧光染料, 在同一管内同时扩增甲基化与未甲基化的 Bis-DNA,反应体系中的饱 和荧光染料会嵌入到扩增形成的双链 DNA(dsDNA)分子中,形成一 条扩增曲线,在扩增结束后不开盖直接运行升温以使双链 DNA 变性 熔解形成高分辨率熔解曲线。通过实时检测 dsDNA 熔解过程中荧光信 号值的变化,并与甲基化参考品曲线对比分析,就能以生成不同形状 (甲基化百分比)熔解曲线的方式将 PCR 产物中存在的差异直观地展 示出来。 二、临床前研究概述 (一)主要原材料 1.主要原材料的选择 本产品的主要原材料包括:引物、甲基化参考品、 PCR反应液、 对照品等,这些原材料通过外购或自制的方式获得。 其中引物及甲基化参考品由申请人自行设计,由合成公司经过合
成、纯化及构建获得; PCR反应液为外购方式获得;对照品由申请人 提取、纯化获得。 申请人对主要原材料进行了供应商的选择,通过功能性试验, 筛 选出合格供应商, 制定了主要原材料的技术要求和质量标准并经检验 合格。 2.企业参考品和对照品的设置情况 本产品企业参考品采用人外周血、人细胞系样本制备, 包括阳性参 考品、阴性参考品、精密度参考品以及分辨率参考品。 阳性参考品 10 支,为不同核酸浓度和不同甲基化水平的样本。阴性参考品 10 支,其中 包含相关同类干扰疾病样本。精密度参考品 3 支,包含不同甲基化水平 样本。分辨率参考品 2 支,为一定核酸浓度不同甲基化水平的 DNA 样 本。 本产品设置了阴性对照品和阳性对照品各 1 支, 为人类基因组 DNA,用于检测过程中试剂和仪器的质量控制。 (二)生产工艺及反应体系研究 申请人通过功能性试验, 确定最佳的生产工艺。 申请人对该产品反应体系的研究包括重亚硫酸盐转化试剂反应体 系的建立与优化、引物浓度确定、 PCR反应液的选择等;对PCR反应 条件的研究包括退火温度及时间、循环数等;起始熔解温度、终止温 度、荧光采集频率、截取温度等。此外,还对样本的用量以及样本保 存时间进行了研究。 (三)分析性能评估
本产品分析性能评估内容主要包括: 准确性、精密度、 分辨率、 分析特异性等。 准确度研究中,申请人分别使用 3 批试剂对不同核酸浓度和甲基 化水平经临床诊断为系统性红斑狼疮(Systemic Lupus Erythematosus, SLE)(包括活动期和稳定期)样本和 SLE 阴性样本(包括其他自身 免疫性疾病样本, 如类风湿性关节炎、干燥综合征、皮肌炎等和健康 体检样本)进行检测,研究结果显示试剂盒检测结果与测序结果阳性 符合率为 100%、阴性符合率为 100%。 精密度研究中,申请人分别使用 3 批试剂对不同甲基化水平的临 床样本进行检测,结果符合预期要求。批内、批间、日内、日间、操 作者间、室间、设备间重复性好。 分辨率研究中,申请人采用细胞系制备不同甲基化水平梯度样本, 使用 3 批试剂进行检测, 确定可与基线清晰区分的最小区间作为本产 品的分辨率。分别使用 3 批试剂对分辨率参考品和临床样本进行检测, 验证了本产品的分辨率为 3%。 分析特异性包含交叉反应研究及干扰物质研究。 交叉反应研究显 示:本试剂盒对于感染性疾病(病毒性肝炎、肺炎、败血症/脓毒血症、 麻风、结核)、肿瘤(如白血病、鼻咽癌、乳腺癌等)、免疫炎症性 疾病(银屑病、系统性血管炎、过敏性紫癜)的特异性均超过 97% 。 对于自身免疫性疾病(类风湿性关节炎、原发性干燥综合征、皮肌炎) 的特异性均超过 85%。研究结果表明,本试剂盒与下述疾病(原发性 干燥综合征、皮肌炎)存在一定的交叉反应性,与其他疾病无交叉反
应。干扰实验结果显示: 200mg/mL 的血红蛋白、0.2mg/mL 游离胆红 素、 37mmo/L 甘油三酯、 120mg/mL 血清白蛋白、 5mg/mL 胆固醇; 60μg/mL 环磷酰胺、7.5μg/mL 羟氯喹、90ng/mL 甲泼尼龙、100mg/mL 感冒灵胶囊、 75μg/mL 盐酸左氧氟沙星和 312μg/mL 头孢克肟不影响 实验结果。 申请人采用临床全血样本进行了核酸提取试剂盒性能研究,并根 据与该产品的组合性能研究结果, 确定推荐的核酸提取试剂符合检测 要求。 申请人对 10 例 SLE 疑似样本进行了动态监测研究,收集病例在 0 个月、 3 个月和 6 个月采集的样本,评估不同时间段采集的样本检测 靶标结果是否稳定。结果显示本试剂在不同时间段对样本的检测结果 具有一致性。 (四)阳性判断值研究 申请人对 2298 例样本进行检测,以临床诊断结果为对比,通过 ROC 曲线统计分析,确定了本试剂盒的阳性判断值为 25%。阳性范围 为甲基化水平≤25%,阴性范围为甲基化水平>25%。研究样本包括: 1024 例 SLE 患者、512 例健康对照、388 例类风湿性关节炎患者和 374 例干燥综合症患者。 (五)稳定性研究 申请人对该产品的稳定性研究包括实时稳定性、反复冻融稳定性、 开瓶稳定性、运输稳定性、全血样本稳定性、全血 DNA 样本稳定性、 转化后的 DNA(bis-DNA)稳定性。
实时稳定性: 将 3 批试剂盒置于规定储存条件下放置 0、3、6、9、 12 、14 、16 个月, 每到一个时间节点使用企业参考品对试剂盒的性能 进行检测,结果显示试剂盒在生产后保存至 14 个月各项性能指标均符 合产品技术要求, 产品有效期 12 个月。 申请人对产品的反复冻融稳定性、开瓶稳定性、运输稳定性和样 本稳定性分别进行了研究。结果显示,产品的性能均能满足产品说明 书的声称。 申请人对全血样本稳定性、核酸提取液稳定性及转化后 DNA 稳定 性进行了研究。 产品的性能均能满足产品说明书的声称。 三、临床评价概述 申请人在北京协和医院、广东省人民医院、深圳市人民医院共三 家临床机构完成了临床试验。入组病例包括风湿免疫科、皮肤科有疑 似系统性红斑狼疮一项或者多项症状、体征的病例人群,如:发热、 关节肌肉症状、皮肤损害、血液学异常、肾脏病变、心血管系统症状、 呼吸系统症状、消化系统症状、神经系统症状、实验室检查指标中自 身抗体异常者等。样本类型为血液样本。临床试验包括三部分。 第一部分,采用试验用体外诊断试剂与系统性红斑狼疮临床参考 标准进行比较研究,对于临床参考标准无法确认的早期病例进行跟踪 随访,综合临床参考标准与跟踪随访结果对产品临床性能进行评价。 临床试验共入组受试者 1126 例,其中临床参考方法确认系统性红斑狼 疮病例 602 例,非系统性红斑狼疮病例 524 例;具有系统性红斑狼疮 相关临床症状的病例中早期症状病例 576 例,非早期症状病例 550 例。
试验结果显示,本产品与临床参考标准相比,临床灵敏度为 90.53% (95%CI:87.91%,92.75%),临床特异度为 92.56%(95%CI:89.97%, 94.65%); 具有早期症状的病例中,本产品与临床参考标准相比, 临 床灵敏度为 87.16%(95%CI:80.68%,92.09%)。 此外,临床试验还纳入 330 例病例,采用试验体外诊断试剂与焦 磷酸测序方法进行比较研究,确认本产品的临床检测性能。试验结果 显示: 阳性符合率为 92.12%,阴性符合率为 93.94%, 总符合率为 93.03%。上述结果显示两者之间具有良好的一致性,本产品临床检测 性能满足要求。 另外,采用试验体外诊断试剂与系统性红斑狼疮实验室自身抗体 检测指标进行性能比较。实验室自身抗体检测与临床参考标准比对, 针对抗核抗体检测,灵敏度: 97.90%,特异度: 40.79%;针对抗 Sm 抗体检测,灵敏度:25.79%;特异度: 98.58%;针对抗 dsDNA 抗体 检测, 灵敏度: 54.93%;特异度: 92.07%;试验体外诊断试剂, 灵敏 度: 89.94%,特异度 92.35%。试验体外诊断试剂能够联合其它实验室 指标,用于系统性红斑狼疮的辅助诊断。 综上所述,临床试验结果显示本产品的临床性能满足技术审评要 求。 四、产品受益风险判定 本产品根据 YY/T 0316-2016 医疗器械风险管理对本产品的安全 风险分析方式,对本产品进行风险分析。 (一) 受益评估
SLE 是一种多器官、多系统受累的自身免疫性疾病。临床表现为 肾脏、皮肤、神经精神、血液、骨关节、肺脏、心脏及胃肠道等多器 官受损。由于 SLE 早期疾病中临床症状和体征的异质性和非特异性, 导致 SLE 临床诊断及分类困难,在 SLE 患者出现重要器官受累前进行 早期诊断,对于 SLE 的防治、改善患者的生活质量、提高患者生存率 具有十分重大的意义。该产品临床上联合其它实验室指标,用于系统 性红斑狼疮的辅助诊断。基于现有临床试验结果, 该试剂盒对 SLE 的 临床灵敏度为 90.53%,特异性为 92.56%,对早期病例的相对危险度 为 RR=17.06。 (二) 风险评估 本产品不能作为 SLE 确诊的唯一依据, 临床医生需结合其他症状 体征或检查进行综合诊断。基于对主要剩余风险的控制在试剂盒说明书 中明确局限性: 1.预期用途:本试剂盒用于体外定性检测人全血样本中的 IFI44L (干扰素诱导蛋白 44L)基因启动子区域 DNA 甲基化水平。 本产品临床上联合其它实验室指标,用于系统性红斑狼疮的辅助 诊断。 2.警示及注意事项:该试剂盒说明书中明确了该试剂盒检测方法 的局限性及使用中的注意事项。
本申报项目为境内第三类体外诊断试剂产品注册,属于创新医疗 器械(创新审查受理号:CQTS1900181)。依据《医疗器械监督管理 条例》(国务院令第 739 号)、《体外诊断试剂注册与备案管理办法》 (国家市场监督管理总局令第 48 号)等相关医疗器械法规与配套规 章, 经对申请人提交的注册申报资料进行系统评价, 申报产品符合安 全性、有效性的要求,符合现有认知水平,建议准予注册。
2024 年 2 月 2 日
附件:产品说明书
IFI44L 基因甲基化检测试剂盒(PCR-熔解曲线法) 说 明 书 【产品名称】 通用名称: IFI44L 基因甲基化检测试剂盒(PCR-熔解曲线法) 【包装规格】20 测试/盒、 40 测试/盒 【预期用途】 本试剂盒用于体外定性检测人全血样本中的 IFI44L(干扰素诱导蛋白 44L)基因启动子区域 DNA 甲 基化水平。 本产品临床上联合其它实验室指标, 用于系统性红斑狼疮的辅助诊断。 系统性红斑狼疮(systemic lupus erythematosus ,SLE)是一种多器官、多系统受累的自身免疫性疾病。 临床表现为肾脏、皮肤、神经精神、血液、骨关节、肺脏、心脏及胃肠道等多器官受损。由于 SLE 早期疾 病中临床症状和体征的异质性和非特异性,导致 SLE 临床诊断及分类困难,在 SLE 患者出现重要器官受 累前进行早期诊断, 对于 SLE 的防治、改善患者的生活质量、提高患者生存率具有十分重大的意义(1)。 表观遗传学研究表明,SLE 患者外周血细胞中IFI44L 基因启动子区域两个位点的DNA 低甲基化在SLE 患者 CD4+T 细胞中异常活化及 SLE 发生发展中发挥着重要的作用(2)。IFI44L 是一种干扰素诱导基因,研 究证实Ⅰ型干扰素通路在 SLE 发病过程中起着十分重要的作用。通过大样本实验研究, 证实 SLE 患者外 周血细胞中 IFI44L 基因启动子区域 DNA 甲基化水平较正常人和类风湿性关节炎(RA)患者、干燥综合 症(SS)患者显著降低,其特异性和敏感性高达 90%以上。因此, IFI44L 是一种重要的 SLE 基因诊断标 志物(3)。 【检验原理】 本产品原理包括两个步骤: 步骤 Ⅰ, 用试剂盒 A 将提取的人全血基因组 DNA 进行重亚硫酸盐处理,DNA 双链中未甲基化的胞 嘧啶(cytosine ,C)脱氨形成尿嘧啶(uracil ,U),而甲基化的胞嘧啶(即 5mC)则保持不变。 步骤 Ⅱ, 将重亚硫酸盐转化后的 DNA(Bis-DNA) 做 PCR 扩增及熔解曲线分析。本试剂盒 B 中含有 甲基化特异性引物和饱和荧光染料,在同一管内同时扩增甲基化与未甲基化的 Bis-DNA,反应体系中的饱 和荧光染料会嵌入到扩增形成的双链 DNA(dsDNA)分子中, 形成一条扩增曲线,在扩增结束后不开盖 直接运行升温以使双链 DNA 变性熔解形成高分辨率熔解曲线。通过实时检测 dsDNA 熔解过程中荧光信号 值的变化,并与甲基化参考品曲线对比分析,就能以生成不同形状(甲基化百分比)熔解曲线的方式将 PCR 产物中存在的差异直观地展示出来。 【主要组成成分】
- 13 -
注: 1. 不同批号的试剂不可混用。 2. 自备试剂及耗材(本试剂盒不包含但本实验必需): (1)全血基因组 DNA 提取试剂:西安天隆科技有限公司的核酸提取或纯化试剂(备案号:陕西械备 20140007、陕西械备 20210031 号) 和深圳市赛尔生物技术有限公司的核酸提取或纯化试剂(备案号: 粤 深械备 20220285、粤深械备 20220286)。 (2)无水乙醇(分析纯,纯度>99.5%)。 (3)根据各实验室荧光定量 PCR 仪和实验需求,自备荧光定量 PCR 反应 8 联管或者 96 孔反应板及封 板膜。 (4)0.2mL 和 1.5mL 离心管(无菌包装) 、移液器及 PCR 专用吸头。 【储存条件及有效期】 1.试剂盒 A(重亚硫酸盐转化试剂)储存于 4~30℃, 试剂盒 B(核酸扩增试剂)储存于-20±5℃。有效期为 12 个月。 2.试剂盒 B(核酸扩增试剂)应避免反复冻融(冻融次数不得超过 6 次) 。 3.开瓶有效期: 试剂盒 B(核酸扩增试剂)开瓶后-20±5℃可储存 60 天;试剂盒 A(重亚硫酸盐转化试剂) 开瓶后 4~30℃可储存 60 天。 4.运输条件:本试剂盒 25℃运输,时间不超过 5 天。 5.生产日期、失效日期见标签。 【适用仪器】 具备 HRM 检测及分析程序的实时荧光定量 PCR 仪: 罗氏诊断公司: LightCycler® 96、LightCycler® 480II 实时荧光定量 PCR 仪; 杭州博日公司:FQD-96C 实时荧光定量 PCR 分析仪。 【样本要求】 1. 样本类型: EDTA 抗凝全血,不能使用肝素抗凝血。 2. 采样方法: 采用 EDTA 抗凝管收集 2mL 静脉血。 3. 样本保存:全血样本采集后若不立即检测,应在 2~8℃保存,时间不超过一周; 一周以上应在-20℃保 存,避免反复冻融(不超过 3 次)。 4. 全血样本、提取的 DNA 样本,在-20℃保存,时间不超过二年。 5. 样本运输: 抗凝全血在 2~30℃运输,时间不超过 3 天。 【检验方法】 1. M-洗涤缓冲液按照下表比例分别加入无水乙醇,并在瓶盖和瓶身上标识√ 。室温保存。
(注: 试剂盒使用前各组分应平衡至室温,液体试剂混匀后使用。各试剂使用后, 请旋紧瓶盖。) 2. 人外周血 DNA 提取 2.1 建议取 200μLEDTA 抗凝全血样本,进行 DNA 提取。 2.2 本试剂盒不含 DNA 提取试剂,各实验室可选择西安天隆科技有限公司的核酸提取或纯化试剂(备案号: 陕西械备 20140007、陕西械备 20210031 号)和深圳市赛尔生物技术有限公司的核酸提取或纯化试剂(备 案号: 粤深械备 20220285、粤深械备 20220286),进行全血基因组 DNA 提取。 2.3 提取的 DNA 样本浓度不低于 10ng/μL,OD260/OD280 位于 1.5~2.0 区间, 体积不少于 20μL。 2.4 DNA 样本建议立即使用,如需保存, 置于-20℃,避免反复冻融(不超过 3 次) 。
3. 重亚硫酸盐转化(试剂盒 A 试剂) 3.1 取 0.2mL 离心管或 8 联管, 每管加入 130μL 的重亚硫酸盐转化试剂, 再加入 20μL 的 DNA 样本, 充分 混匀后短暂离心,确保管盖和管壁无残留液滴。 3.2 反应体系配制好以后,在 PCR 仪等可设置温度变化程序的仪器上进行重亚硫酸盐转化,具体程序如下:
3.3 取吸附柱放入收集管,每管加入 600μL 的 M-结合缓冲液,将上述 3.2 步骤反应体系全部转移到吸附 柱, 盖紧盖子颠倒混匀, 使反应体系与 M-结合缓冲液充分混合。12000rpm 离心 1min,倒掉收集管中废 液。 3.4 向吸附柱中加入 100μL 的 M-洗涤缓冲液(已按要求加入无水乙醇) ,12000rpm 离心 1min。 3.5 向吸附柱中加入 200μL 的 L-去硫缓冲液, 室温放置 15~20min , 12000rpm 离心 1min。倒掉收集管中 废液。 3.6 向吸附柱中加入 200μL 的 M-洗涤缓冲液, 12000rpm 离心 1min。 3.7 重复操作步骤 3.6 步骤。倒掉收集管中废液,12000rpm 空柱离心 1min。 3.8 将吸附柱转移到 1.5mL 新的离心管中, 向吸附柱中加入 30μL 洗脱缓冲液(EB), 室温放置 2min, 12000rpm 离心 1min,得到转化后的 DNA 样本。 3.9 测定转化后的样本 DNA 浓度,用 EB 洗脱缓冲液将各样本稀释至相近浓度(1~6ng/μL)。建议立即 使用, 如需保存,在-20℃以下, 时间不超过两个月,避免反复冻融(不超过 3 次) 。 注: 实验时空白对照用无酶 H2O 代替,视为全血样本参加核酸提取、转化和扩增的全过程,阴性对照、阳 性对照的加样操作参照 DNA 样本, 参加转化和扩增的过程。 4. 实时 PCR 扩增检测(试剂盒 B 试剂) 4.1 PCR 扩增试剂准备(在分子实验室试剂准备区进行) 4.1.1 将试剂盒 B 在室温下解冻, 待完全融化, 充分混匀后离心备用。 4.1.2 结合仪器和实验需求,按下表配制除模板以外的 PCR 反应体系总量:
注: N 测试=样本数(n)+阳性对照(1)+阴性对照(1)+空白对照(1)+甲基化参考品(5)+损耗量(2) 4.1.3 将上述 PCR 反应体系充分混匀后, 以每管或孔 15 μL 分别加入 PCR 反应管或 PCR 反应板中,做好 标识, 转移到样本制备区,剩余试剂放置-20±5℃保存。 4.2 加样(在分子实验室样本制备区进行) 取 5μL 五种甲基化参考品和转化后的 DNA 样本、空白对照、阴性对照、阳性对照,分别加入到上述 PCR 反应管或 PCR 反应板中,盖紧管盖, 短暂离心,放入 PCR 仪。 4.3 罗氏 LightCycler® 96 仪器设置 参照仪器/软件使用说明书,检测荧光选择“ResoLight”,反应体积设置“20μL”,按下表编辑运行程序。
PCR 程序运行结束,使用 LightCycler® 96 应用软件打开 PCR 程序运行文件,点击“Analysis”菜单, 在 工具栏选择“AddAnalysis”图标, 对话框出现后选择“High Resolution Melting”,分析处理结果。 4.4 罗氏 LightCycler® 480II 仪器设置
参照仪器/软件使用说明书,检测荧光选择“SYBR Green I/HRM Dye(465-510)ℽ , 反应体积设置“20μL”, 按下表编辑运行程序。
PCR 程序运行结束,使用 LightCycler® 480 Gene Scanning Software Version 1.5 应用软件打开 PCR 程序 运行文件, 点击“Analysis”按钮, 在对话框“Create New Analysis”中选择“Gene Scanning”分析程序,分析处 理结果。 4.5 杭州博日的实时荧光定量 PCR 分析仪(FQD-96C)仪器设置 参照仪器/软件使用说明书,检测荧光选择“SYBR Green I”,反应体积设置“20μL”,按下表编辑运行程 序。
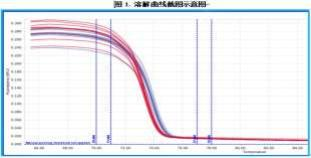
PCR 程序运行结束, 点击“分析” ,在对话框“高分辨率曲线”分析数据。 5. 结果分析 在熔解曲线(Melting Curves)上截取荧光值变化最快的一段(一般熔解温度在 70~78℃) (见图 1), 阈值(Threshold)设置为“0”,按比例对截取的熔解曲线进行归一处理后,使用荧光差值图(Difference Plot) 判读结果。
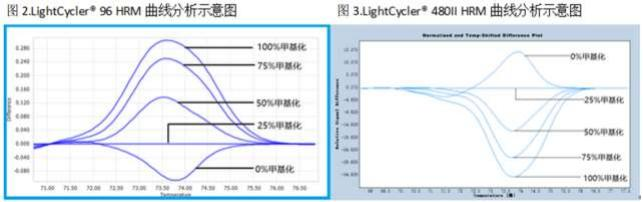
5.1 建立甲基化百分比标准曲线 选择 25%甲基化参考品作为基线样本,与 0%、50%、75%、100%甲基化参考品曲线共同构成甲基化百 分比参考曲线 (25%甲基化参考品曲线为横坐标,LightCycler® 96 所得甲基化参考品曲线如图 2 , LightCycler® 480II 所得甲基化参考品曲线如图 3,其他仪器同此设置) 。 待测样本结果判定: 分析待测样本曲线与甲基化百分比参考品曲线位置,判断待测样本甲基化水平百分 比区间。 5.1.1 待测样本曲线在甲基化百分比参考品曲线 0%和 25%之间, 则待测样本的甲基化百分比结果为 0%~ - 16 -
25%,属阳性值范围,提示待测样本的甲基化水平降低, 与 SLE 疾病高度相关。 5.1.2 待测样本曲线在甲基化百分比参考品曲线 25%~100%之间,属阴性范围,提示待测样本的甲基化程 度属于正常水平,具体结果按 25~50% 、50~75%和 75~100%来表示。 5.2 若甲基化百分比参考品曲线出现位置颠换、曲线重合、界限不分明等异常情况,表明实验结果不准确, 检测结果无效。需重复“实时 PCR 扩增”步骤后, 重新判定结果。 5.3 若待测样本的曲线最右端没有与甲基化百分比参考品曲线一同汇集在基线(零刻度线)附近,而是与 基线(零刻度线)有一定距离,或待测样本无扩增曲线,提示待测样本结果不正确,与亚硫酸盐转化步 骤误差,或样本 DNA 质量相关, 重做实验。 5.4 若甲基化百分比参考品曲线变形或错位,或者样本和参考品均无扩增曲线,应检查 PCR 步骤操作误差, 实验需重做。
注:上图是以 25%甲基化参考品为基线样本得到的荧光差值图(difference plot),横坐标表示 DNA 双螺旋结构解链时的温度,纵坐标表示荧光差值。LightCycler® 96 曲线从上往下依次为 100%、75%、50%、 25%和 0%的甲基化参考品检测结果; LightCycler® 480II 曲线从上往下依次为 0% 、 25% 、50% 、75%和 100%的甲基化参考品检测结果, 其余仪器 HRM 曲线同图 2。 【阳性判断值】 对临床样本进行 ROC 曲线统计分析得出本试剂盒的阳性判断值为 25%,阳性范围为≤25%,阴性范围 为>25%。 【检验结果的解释】 1.每次实验均需同时检测 5 种甲基化参考品, 应符合结果分析中的要求。 2.根据本试剂盒研制结果,待测样本的甲基化水平≤25%,属于降低水平,可初步诊断为 SLE,建议结合临 床症状和体征及其他实验室检查进一步确诊。待测样本的甲基化水平>25%,属于正常水平, 需结合临 床症状/体征及其他实验室检测指标进一步排除 SLE。 3.实验中出现个别样本曲线峰值低于 0%甲基化参考品曲线,为仪器本身出现的微弱波动导致,结果仍按照 0%~25%判断。 4.无论待测样本是阳性还是阴性,都应有扩增曲线,否则应按异常结果查找原因。 5.如果样本曲线贴近 25%的基线并与其相交叉,可以认为甲基化水平与基线一致, 结果判为阳性。 6.本试剂盒阳性对照的甲基化水平应≤25%,阴性对照的甲基化水平应>25%,空白对照应无扩增曲线,否 则应按异常结果查找原因。 【检验方法的局限性】 1. 本试剂盒仅供体外诊断用,疾病确诊应结合症状/体征、病史、其他实验室检查及治疗反应等情况综合考 虑。 2. 异常实验结果的可能性分析 2.1 不正确的样本采集、转运、保存及处理。 2.2 核酸提取失败,或者提取的核酸浓度不够(会导致 PCR 扩增无产物, 出现无扩增曲线和 HRM 曲线的 结果) 。 2.3 不规范的亚硫酸盐转化操作及模板保存问题可能导致结果不正确(HRM 曲线右侧不归零) 。 【产品性能指标】 1.阳性符合率: 检测 10 份企业阳性参考品,结果应均为阳性。 2.阴性符合率: 检测 10 份企业阴性参考品,结果应均为阴性。
3.精密性: 检测企业精密性参考品各 10 次, 结果应均符合技术要求。 4.分辨率: 本试剂盒分辨率为 3%。 5.干扰实验:200mg/mL 的血红蛋白、 0.2mg/mL 游离胆红素、37mmo/L 甘油三酯、 120mg/mL 血清白蛋白 和 5mg/mL 胆固醇不影响实验结果。 6.交叉反应研究显示:本试剂盒对于①感染性疾病:病毒性肝炎、肺炎、败血症/脓毒血症、麻风、结核、 ②血液系统肿瘤、实体瘤、病毒相关肿瘤:白血病、多发性骨髓瘤、淋巴瘤、乳腺癌、肺癌、鼻咽癌、宫 颈癌、 ③免疫炎症性疾病:主要包括银屑病、系统性血管炎、过敏性紫癜的特异性均超过 97%。对于④自 身免疫性疾病: 主要有类风湿性关节炎、原发性干燥综合征、皮肌炎的特异性均超过 85%。上述研究结果 表明,本试剂盒与下述疾病(原发性干燥综合征、皮肌炎)存在一定的交叉反应性,与其他疾病无交叉反 应。 7.临床有效性: 通过三家临床机构共纳入 1126 份病例, 除 SLE 外, 包括 RA 、SS、皮肌炎、硬皮病、成人 still’s 病等其他自身免疫性疾病, 其临床灵敏度为 90.53%,临床特异性为 92.56%。 【注意事项】 1.本试剂盒仅供体外诊断用。使用前需仔细阅读说明书并严格按照其内容操作。 2.为了避免样本中任何潜在的生物危险因素, 待检样本应视为具有潜在传染性,避免接触皮肤与粘膜;样 本的处理建议在样本制备区进行,样本的操作和处理均需符合《医疗机构临床基因扩增实验室管理办法》 等相关法规要求。 3.使用本试剂盒的操作人员应接受核酸提取与扩增或分子生物学方法检测的专业培训, 具备相应的实验操 作资格;实验室应具备合理的生物安全防备设施及防护程序。 4.操作过程要注意核酸酶对 DNA 的降解作用, 应使用专用移液器, 无核酸酶的离心管及一次性吸头。 5.本试剂盒中重亚硫酸盐转化试剂和 PCR 反应液需避光保存和操作。 6.试剂盒使用前应平衡至室温。各组分使用前应充分混匀。 【参考文献】 1. TsokosGC.Systemic lupus erythematosus.NEnglJ Med 2011;365:2110-21. 2. Zhao M,LiuS,LuoS,etal.DNA methylation and mRNA and microRNA expression of SLE CD4+ T cells correlate with disease phenotype.J Autoimmun 2014;54:127-36. 3. Ming Zhao,YinZhou,et al.IFI44L promoter methylation as a blood biomarker for systemic lupus erythematosus. Ann Rheum Dis2016;75:1998-2006. 【基本信息】 注册人/生产企业名称:深圳市赛尔生物技术有限公司 住所: 深圳市宝安区西乡街道鹤洲恒丰工业城 B6 栋 201A 联系方式: 售后服务单位名称: 联系方式: 生产地址: 深圳市宝安区西乡街道鹤州恒丰工业城 B6 栋 201A 生产许可证编号: 【医疗器械注册证编号/产品技术要求编号】 【说明书核准日期及修改日期】 核准日期: 年 月 日 修改日期: 年 月 日 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||