皕晟百科
ENCYCLOPEDIAS
|
【技术审评报告】可降解镁金属闭合夹受理号: CQZ2201178
医疗器械产品注册技术审评报告
产品中文名称:可降解镁金属闭合夹 产品管理类别:第三类 申请人名称:苏州奥芮济医疗科技有限公司
国家药品监督管理局 医疗器械技术审评中心
目 录
基本信息 3 一、申请人名称 3 二、申请人住所 3 三、生产地址 3 技术审评概述 4 一、产品概述 4 二、临床前研究概述 5 三、临床评价概述 7 四、产品受益风险判定 9 综合评价意见 12
一、 申请人名称 苏州奥芮济医疗科技有限公司 二、申请人住所 常熟经济开发区海城路 2 号 12 幢 三、生产地址 常熟经济开发区海城路 2 号 12 幢
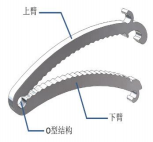
一、产品概述 (一)产品结构及组成 该产品由可降解镁金属闭合夹和基座组成, 镁金属闭合 夹包括上臂、下臂和尾部 O 型结构三部分,放置于基座内。 产品经辐照灭菌, 一次性使用。产品货架有效期 3 年。
产品结构如图 1 所示:
镁金属闭合夹结构示意图
基座示意图 图 1 产品示意图
(二)产品适用范围 用于外科手术不需要提供永久闭合力的血管或胆管等 管状组织的结扎和闭合, 不适用于大动脉和大静脉。 (三)型号/规格 产品型号规格见表 1。 表 1 产品型号规格
手术过程中将所需闭合的血管等管状组织放置在上、下 臂之间的空隙,通过挤压上臂和下臂,使其夹角逐渐减小, 直至上臂与下臂自锁结构锁定闭合,从而夹闭管腔,起到结 扎封闭效果。植入体内后能够被人体降解吸收。 二、临床前研究概述 (一) 产品性能研究 1.产品技术要求研究 产品技术要求研究项目如表 2 所示。 表 2 产品技术要求研究项目摘要
2.产品性能评价 申请人提交了产品设计验证报告, 验证项目包括: 结构 及规格尺寸、夹闭尺寸范围、硬度、粗糙度、密封性能、体
外降解性能、电化学性能、原材料性能、 MRI 兼容性、联合 使用器械配合性能、加工过程中残留物及清洗剂残留量验 证、产品缺陷研究等。 产品性能研究资料表明产品符合设计输入要求。 (二)生物相容性 该产品为植入器械,与组织持久接触。申请人依据 GB/T 1688 系列标准对产品进行了生物相容性评价, 生物学评价终 点有:细胞毒性、致敏、皮内反应、急性全身毒性、遗传毒 性、亚慢性毒性、局部植入反应、生物降解、血液相容性、 慢性毒性、毒代动力学、致癌性、免疫毒性和生殖/发育毒性、 热原。通过体内降解代谢情况研究资料,对产品的降解周期 以及降解产物代谢转归等进行了评估。综合材料表征、生物 学试验、动物试验、临床试验随访情况,经综合评估,该产 品的生物相容性风险可接受。 (三)灭菌 该产品采用辐照灭菌, 辐照剂量为 25-40kGy。申请人提 供了灭菌确认报告,支持所采用灭菌工艺可达 10-6 无菌保证 水平。 (四)产品有效期和包装 该产品货架有效期为 3 年, 申请人提供了货架有效期验 证报告,开展实时老化试验, 包括产品稳定性验证、模拟运 输试验验证和包装完整性验证资料。
申请人开展了以巴马小猪为模型的动物试验研究, 将已 上市的 ABSOLOCK EXTRA 结扎钉夹作为对照产品,评价指 标包括有效性指标(以术中闭合性能、降解和吸收时间、滑 脱和移位、辅助器械适配性等)和安全性指标(生命体征、 生理代谢、实验室检查、组织病理学观察和 B 超检查等)。 动物试验结果表明, 可降解镁金属闭合夹的安全性和有 效性动物试验结果与对照产品基本一致。产品达到预期设计 要求。 三、临床评价概述 申报产品通过临床试验路径进行临床评价,采用前瞻 性、多中心、随机、单盲、平行对照的非劣效试验设计,对 照组为德国 Johnson & Johnson MEDICAL GmbH 生产的结扎 钉夹,该临床试验共在 3 家临床机构开展,按 1:1 入组,样 本量为 156 例。 主要疗效指标为:术后 14±2 天成功夹闭血管和/或组织, 未出现出血或组织液渗漏的有效率。 次要疗效指标为: 术中即刻成功夹闭有效率、术后 3±1 天成功夹闭有效率、成功夹闭时间、术后引流量评价、产品 性能评价。 安全性评价指标主要包括术后 3±1 天、 14±2 天、 90±10 天、 180±15 天、 360±20 天与试验用产品相关的实验室检查、
生命体征检查、研究期内出现的出血、组织液渗漏、腹腔脓 肿、动脉栓塞、异物不适感、发热黄疸、感染等临床症状情 况、不良事件和严重不良事件发生率。 临床试验结果实际纳入统计全分析集(FAS)共 156 例, 符合方案分析集 153 例, 安全数据集 156 例。临床试验结果 显示: 1.主要有效性评价指标 在 FAS 人群中, 试验组成功夹闭有效率为 96.15% (n=78),对照组有效率为 96.15%(n=78),两组率差的 95% 可信区间为 0.00%(-6.04%,6.04%),差值下限大于预先设置 的非劣效界值- 10%,拒绝无效假设,非劣效的研究假设成立 (P<0.001)。 在 PPS 人群中,试验组成功夹闭有效率为 96.00% (n=75),对照组有效率为 96.15%(n=78),两组率差的 95% 可信区间为-0.15%(-6.31%,6.00%),差值下限大于预先设置 的非劣效界值- 10%,拒绝无效假设,非劣效的研究假设成立 (P<0.001)。 2.次要有效性评价指标 除了成功夹闭时间统计学差异有统计学意义外, 其他术 中即刻成功夹闭有效率、术后 3±1 天成功夹闭有效率、术后 引流量评价, 产品性能评价, 在 FAS 和 PPS 的结果均显示试 验组和对照组差异无统计学意义。
在安全集 SS 有关不良事件、严重不良事件、合并用药、 生命体征、实验室检查、并发症的结果显示试验组和对照组 数据差异无统计学意义。 综上,临床评价资料符合目前临床审评要求。 四、产品受益风险判定 该产品主要临床受益为可以为外科手术不需要提供永 久闭合力的血管或胆管等管状组织的结扎和闭合, 主要临床 风险为对于中重度肾功能不全者或超大剂量植入后, 可能存 在因镁代谢吸收不良导致体内电解质紊乱的风险。根据申请 人提供的申报资料,经综合评价,在目前认知水平上, 认为 该产品的上市为适用人群带来的受益大于风险。但为保证用 械安全,基于对主要剩余风险的规避,需在说明书中提示以下 信息: (一)产品适用范围 用于外科手术不需要提供永久闭合力的血管或胆管等 管状组织的结扎和闭合, 不适用于大动脉和大静脉。 (二)警示及注意事项 1.铝箔袋包装破损和超过有效期的应禁止使用。 2.本产品为一次性使用,严禁重复使用,未用完的应按 医疗垃圾处理规定处理。 3.本产品操作详见使用方法,必须由专业的外科医生在
手术室环境下进行操作, 使用数量由外科医生根据临床实际 判断。建议成人植入体内的镁夹不超过 30 枚,儿童不超过 10 枚。 4.本产品取出前应先检查施夹钳的钳口处,确定无组织 或异物残留;取夹后,应张闭一次施夹钳(产品不闭合)并 观察产品,若发生脱落或变形应禁止使用。 5.本产品使用时,被闭合血管和组织与周边组织应进行 剥离, 并确保被闭合血管和组织完全位于产品上下臂的中间 位置, 应避免夹闭在 O 型处; 在操作完成后务必检查闭合部 位,确保产品正确有效地闭合。 6.本产品夹闭较大直径的血管或组织时,应注意血管或 组织是否在闭合范围内;在近心端夹闭至少 2 枚, 在远心端 夹闭至少 1 枚;无需额外使用止血钳。 7.本产品配套使用器械的产品名称为施夹钳,注册证号 为苏械注准 20182021309,规格型号为 SJQ-S、SJQ-M、SJQ-L, 分别对应产品规格为 JSJ-S 、JSJ-M 、JSJ-L。 8. 除夹钳移除后的产品不得再次使用。 9. 患者术前需进行心脏、肝脏、肾脏等功能性检查,具 体由医生根据病情判断使用, 如中重度肾功能不全者慎用本 产品。 (三)禁忌证 1.本产品不适用于输卵管的避孕结扎。
2.本产品不适用于颅内血管或组织的结扎。 3.本产品不适用于腹腔镜下供体肾切除手术中的肾动脉 结扎。
该 产 品 属 于 创 新 医 疗 器 械(创 新 审查受理号 : CQTS1800018)。申请人的注册申报材料齐全,符合现行要 求。依据《医疗器械监督管理条例》(国务院令第 739 号)、 《医疗器械注册与备案管理办法》(国家市场监督管理总局 令第 47 号)等相关医疗器械法规及配套规章,经系统评价 后,建议准予注册。
2023 年 12 月 6 日 |