皕晟百科
ENCYCLOPEDIAS
|
【技术审评报告】染色体非整倍体及基因微缺失检测试剂盒(可逆末端终止测序法)(CSZ2100214)受理号: CSZ2100214
体外诊断试剂产品注册技术审评报告
产品中文名称:染色体非整倍体及基因微缺失检测试剂 盒(可逆末端终止测序法) 产品管理类别:第三类 申 请 人 名 称:安诺优达基因科技(北京) 有限公司
国家药品监督管理局 医疗器械技术审评中心
目 录
基本信息 3 一、申请人名称 3 二、申请人住所 3 三、生产地址 4 技术审评概述 4 一、产品概述 4 二、临床前研究概述 7 三、临床评价概述 12 四、产品受益风险判定 15 综合评价意见 17
一、申请人名称 安诺优达基因科技(北京)有限公司 二、 申请人住所 北京市北京经济技术开发区科创六街 88 号院 8 号楼 2 单 元 701 室 三、 生产地址 北京市北京经济技术开发区科创六街 88 号院 8 号楼 2 单 元 301 室; 北京市北京经济技术开发区科创六街 88 号院 6 号 楼 1 单元 303 室; 北京市北京经济技术开发区科创六街 88 号 院仓库 K14 室
一、产品概述 (一)产品组成成分
*不同批号的试剂盒组分不可混用。 (二)产品预期用途 本试剂盒用于体外定性检测孕 18-26 周孕妇的羊水样 本中第 13 号、 18 号、 21 号、性染色体的非整倍体,以及 第 15 号染色体 q11.2-q13 区域的缺失情况。 用于产前筛查高风险孕妇、高龄孕妇、超声检查发现 胎儿结构异常且怀疑存在 13、18、21、X、Y 等染色体数目 异常或存在相关染色体微缺失的孕妇, 以及其他具有相关 医学指征的孕妇,进行胎儿 13-三体综合征、 18-三体综合 征、 21-三体综合征、特纳综合征、Klinefelter 综合征、 超雌综合征、超雄综合征 和 Prader-Willi 综合征 / Angelman 综合征产前辅助诊断。 不适用于有染色体异常家族史或有既往不良孕产史或 超声筛查胎儿结构发现明显异常的孕妇,不得用于非医学 指征相关的性别鉴定。在进行该检测前和检测后, 必须结 合孕妇的临床情况(如胎儿超声检查情况)对孕妇及家属 进行相关的产前遗传咨询。相关检测的开展应符合原卫生 部发布的《产前诊断技术管理办法》的相关规定。在进行 该检测前, 必须与孕妇有充分的知情谈话, 需说明该技术 检测的内容、风险和技术局限性,并签署相关的知情同意 书。
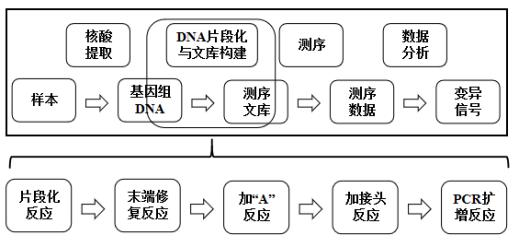
本试剂盒检测结果仅供临床参考,不应作为产前诊断 的唯一依据, 临床医生应结合核型分析、超声检查等检测 结果进行综合判断。阴性结果不能排除其他染色体异常, 其结果的确认应结合临床进行综合判断。 本试剂盒的检测项目应在有产前诊断资质的医疗机构 中开展。项目申请的要求参照我国相关的卫生行业标准。 申请检测的医师应是经过产前诊断专业培训的、有资质的 医师。 本试剂盒对嵌合体样本的检出率较低,当样本为嵌合 体时,会影响本试剂盒检测结果的准确性。 (三)产品包装规格 24 测试/盒。 (四)产品检验原理 本试剂盒基于可逆末端终止测序法,通过对基因组 DNA 进行片段化、末端修复、加 “A”反应、加接头反应及 PCR 富集,在 DNA 片段两端连接上已知的通用接头序列,构建 DNA 文库,并将文库加载到测序芯片上,通过桥式 PCR 扩 增,使文库的每条序列片段形成一个簇。在测序反应中加 入不同颜色的荧光基团标记碱基,在链的延伸过程中,每 个循环只加入一个正确互补的碱基,根据不同的荧光信号 的组合确认碱基的种类, 经过多个循环后, 获得序列信 息。通过对提取的 DNA 进行测序,并将测得的序列与人类
参考基因组的序列进行比对,获得序列在染色体上分布的 信息。通过数学模型计算比对至参考基因组上的序列数, 分析第 13 号、 18 号、 21 号、性染色体是否出现非整倍 性,以及第 15 号染色体 q11.2-q13 区域是否缺失,从而实 现对胎儿染色体疾病的辅助诊断。 二、 临床前研究概述 (一)主要原材料 1.主要原材料的选择 试剂盒主要原材料包括片段化反应酶、片段化反应缓 冲液、终止液、末端修复反应酶、末端修复反应缓冲液、 dNTP、加 “A”反应酶、加 “A”反应缓冲液、接头连接反 应酶、链接反应缓冲液、接头序列、PCR 扩增试剂、扩增 引物、阳性对照品、阴性对照品等。 这些原材料均为外购,接头序列及扩增引物为申请人 自行设计后由专业的公司合成。申请人通过功能性试验, 筛选出最佳原材料和供应商,制定了各主要原材料质量标 准并经检验合格。 2. 企业参考品和对照品设置情况 企业参考品包括阳性参考品 9 支,涵盖该产品可检出 的所有变异类型, 由人源细胞系基因组 DNA 制成。 阴性参 考品 4 支,由该试剂盒检测范围内变异阴性的人组织 DNA 或羊水制成。 检测限参考品 9 支、嵌合体参考品 7 支,包
括最低浓度和最低嵌合百分比参考品,涵盖该产品可检出 的所有变异类型。重复性参考品 3 支, 由对应的变异类型 的人源细胞系基因组 DNA 制成。 试剂盒包括 3 个阳性对照品和 1 个阴性对照品,均为 人基因组 DNA 样本,用于检测过程的质量控制。 (二)生产工艺及反应体系研究 申请人通过功能性实验等研究,确定了试剂盒各步骤 反应参数。 同时研究了配套使用试剂与反应参数,包括样 本采集、配套的核酸提取试剂、核酸纯化试剂、测序试剂 及测序数据量要求等,确定了最佳反应体系。 申请人通过多批次试剂盒的研究与验证,对生产工艺 的参数、关键工序进行了研究和确认,确定了最佳生产工 艺。 (三)分析性能评估 本产品分析性能评估内容包括准确度、精密度、检出 限、分析特异性。 准确度研究中, 申请人对各种染色体非整倍体异常样 本、不同类型的染色体片段缺失样本进行检测,与核型/芯 片结果比较,结果显示阳性符合率为100%, 阴性符合率为 100%,总符合率为100%。另外,使用3批试剂盒对阳性参考 品、阴性参考品进行检测,检测结果显示阳性参考品符合 率、阴性参考品符合率均为100%。
精密度研究中,申请人使用不同试剂批次、 由不同操 作人员在不同实验室、不同测序仪器上,对不同变异类型 的中强阳性、弱阳性以及阴性样本分别进行20 天精密度研 究。研究结果表明,试剂盒在批内/批间、不同操作者、 日 内/日间、不同地点、不同操作者间的精密度良好。 检出限研究中, 申请人使用3个批次试剂盒进行研究, 将13号染色体非整倍体、 18号染色体非整倍体、 21号染色 体非整倍体、性染色体非整倍体以及15号染色体q11.2-q13 缺失的阳性羊水样本与阴性羊水样本混合成不同嵌合比 例, 并采用不同的DNA起始投入量按正交实验设计进行检 测。结果表明, 本试剂盒最低检出限为嵌合比例不低于 30%、DNA起始投入量不低于10 ng,试剂盒检测范围内变异 可稳定检出。 分析特异性研究中,包含干扰研究与交叉反应研究。 关于干扰研究,申请人检测了常见的样本内源性干扰 物以及样本采集和处理过程中引入的外源性干扰物,对羊 水样本中可能存在的内源性干扰物质进行了测试。 结果表 明其中 0.1 mg/mL胆 红 素 、 5 mg/mL 甘 油 三 酯 、 3 mg/mL EDTA-K2、5%血红细胞不会对试剂盒的检测结果造成干扰。 母体白细胞含有的正常女性基因组DNA与胎儿DNA经提取检 测后无法区分,是已知的干扰物质。 母体白细胞污染产生 类似嵌合体的表现会降低阳性样本的检出能力,结果显示
母体白细胞污染对女胎羊水样本检测结果未造成干扰,母 体白细胞污染占比达到20%时会对男胎羊水样本检测结果产 生干扰, 出现性染色体非整倍体异常的假阳性检测结果。 关于交叉反应,申请人对三批次试剂进行研究。使用 试剂盒检测范围外的 T2、T3、T4、T5、T6、T7、T8、T9、 T10 、 T11 、 T12 、 T14 、 T15 、 T16 、 T17 、 T20 、 T22、 1p36.33-p36.22 缺失、 4p16.3-p15.2 缺失、4q31.3-q35 缺 失、 5p15.33-p13.3 缺失、 7q11.23 缺失、 8p23.3-p21.3 重 复、 11q23.3-q25 缺失、 17p12-p11.2 缺失、 22q11.21 缺失 样本进行研究,未发现交叉。研究结果表明,本试剂盒检 测范围外的染色体异常不会影响本产品的分析性能。 (四)阳性判断值 申请人使用已知结果的临床羊水样本,并辅以部分细 胞系样本及模拟嵌合体样本(细胞系样本配制) 进行研 究,共完成 180 例样本检测,对参考值进行了建立。 然后使用 340 例临床羊水样本对参考值进行了验证, 研究结论如下: 1.13 号、 18 号、 21 号染色体非整倍体判断 根据样本对应的 “DV13” 、 “DV18” 、 “DV21”数值 进行判断:当 DV<1.1 时,样本为该染色体三体阴性;当 DV ≥1.1 时, 样本为该染色体三体阳性。 2.性染色体非整倍体判断
根据样本对应的 “DV23”、 “DV24”数值进行判断: a)当 DV24<0.1,且 0.9<DV23<1.1,样本为性染色体 为非整倍体阴性。 b)当 0.4<DV24<0.6,且 0.4<DV23<0.6,样本为性染 色体为非整倍体阴性。 c )其他情况下样本为性染色体非整倍体阳性。 当存在性染色体非整倍体检出阳性时,几种常见的性 染色体非整倍体疾病的染色体数目, 以及与本试剂盒性染 色体参考值的对应关系如下表:
备注: 1、0.1 代表偏离理想值的波动程度; 2、对于检测值不在上述四种典型亚型测值范围内的性染色体 非整倍体的阳性样本,其可能是其他性染色体非整倍体亚型或者嵌 合体; 3、15 号染色体 q11.2-q13 区域缺失判断。 根据样本对应的DVcnv值以及cnv_mark值,如果DVcnv≤-1,且 cnv_mark<0.2时, 判断该区域存在缺失, 否则该区域未检测出缺 失。 (五)稳定性研究
申请人对产品进行了货架稳定性(实时稳定性)、使 用稳定性(开盖稳定性和冻融稳定性)和运输稳定性的研 究,以及与样本相关的稳定性研究(保存稳定性) 。 货架稳定性(实时稳定性)研究中,申请人对连续生 产的三批试剂盒于-15℃以下保存,并于0、3、6、8、10、 12、14月使用企业参考品进行检测,确定试剂盒储存条件 及有效期为-15℃以下储存,有效期9个月。 使用稳定性(开盖稳定性和冻融稳定性)研究中,申 请人通过对产品在开盖模拟使用后不同的时间点以及产品 在冻融不同的次数后使用企业参考品进行检测。研究结果 显示, 各组分开盖后置于-15℃以下储存,冻融次数不超过 6次, 各组分开盖后建议在 3 个月内用完。 样本稳定性: 样本应保存在 2~8℃条件下, 不超过 72h。如不能及时安排提取,羊水样本应在 -15℃以下保 存,可保存 2 年。羊水避免反复冻融。从羊水细胞提取的 DNA,在-15℃以下可保存 5 年, 冻融次数建议不超过 6 次。 三、临床评价概述 申请人在云南省第一人民医院、河北省人民医院、中 国人民解放军空军军医大学第一附属医院(原中国人民解 放军第四军医大学第一附属医院)、重庆医科大学附属第 一医院、济南市妇幼保健院五家临床试验机构开展了临床
试验。临床试验采用试验体外诊断试剂分别与已上市同类 产品和核型分析进行比较研究,确认试验体外诊断试剂的 临床性能。样本类型为羊水样本。 与已上市同类产品对比, 临床试验共纳入有效病例 1519 例, 其中 13 号染色体三体阳性病例 14 例, 18 号染色 体三体 54 例, 21 号染色体三体 181 例, 性染色体非整倍体 174 例,15 号染色体 q11.2-q13 区域缺失(CNVs)3 例。试 验体外诊断试剂与对比试剂检测 13 号染色体三体、 18 号染 色体三体、21 号染色体三体和 15 号染色体 q11.2-q13 区域 缺失阳性符合率均为 100%,阴性符合率均为 100%;检测性 染色体非整倍体阳性符合率 98.85%,阴性符合率 99.85%; 总体阳性符合率 99.53%(95%CI:98.30%,99.87%),阴性 符合率 99.82%(95%CI:99.34%,99.95%)。 与核型分析的比较研究, 共入组有效病例 1512 例。其 中 13 号染色体三体阳性病例 14 例, 18 号染色体三体 54 例, 21 号染色体三体 181 例, 试验体外诊断试剂与核型分 析阳性符合率和阴性符合率均为 100%。性染色体非整倍体 阳性病例总计 174 例,包括(45,X0)21 例、含嵌合体样本 15 例、(47,XXY)80 例、(47,XXX)36 例、含嵌合体样本 2 例、(47,XYY)39 例、含嵌合体样本 1 例。试验体外诊 断试剂与核型分析检测(45,X0) 以及含(45,X0) 的嵌合 体样本阳性符合率 95.24%,阴性符合率 99.80%,21 例阳性
样本中 11 例样本试验体外诊断试剂检测为(45,X0), 9 例 样本试验体外诊断试剂检测为“非典型亚型或嵌合体”,1 例样本试验体外诊断试剂未检出,该样本核型分析为嵌合 体;检测(47,XXY ) 阳 性 符 合 率 100% , 阴 性 符 合 率 99.16%;检测(47,XXX) 以及含(47,XXX) 的嵌合体样本 阳性符合率 100%, 阴性符合率 99.39%,36 例阳性样本中 33 例试验体外诊断试剂检测为(47,XXX), 3 例试验体外 诊 断 试 剂 检 测 为 “ 非 典 型 亚 型 或 嵌 合 体 ” ; 检 测 (47,XYY ) 以及含(47,XYY )的嵌合体病例阳性符合率 100%,阴性符合率 99.25%,39 例阳性样本试验体外诊断试 剂均检测为(47,XYY); 1 例样本试验体外诊断试剂检测异 常, 核型分析分别为未见异常, 分析可能亦为嵌合体影 响。与核型分析对比总体阳性符合率 99.76%(95%CI : 98.67%,99.96%),阴性符合率 99.91%(95%CI:99.48%, 99.98%)。 综上,临床试验结果显示试验体外诊断试剂临床性能 满足临床使用需求。该产品预期用途包含 Prader-Willi 综 合征/Angelman 综合征辅助诊断, 该疾病为列入罕见病目录 的疾病,按照《用于罕见病防治医疗器械注册审查指导原 则》的相关要求,请申请人于上市后收集临床应用数据, 将本产品检测结果与 Prader-Willi 综合征/Angelman 综合 征临床诊断结论进行对比,应至少收集到 10 例确诊病例,
评价本产品临床性能。相关资料应由临床机构签章, 于产 品延续注册时提交。 依据“YY/T 0316-2016 医疗器械风险管理对医疗器械 的应用”标准,对该产品进行风险分析。 经综合评价,在目前认知水平上,认为该试剂盒上市 带来的受益大于风险。为保证用械安全,基于对主要剩余 风险的规避,在说明书中提示: 不适用于有染色体异常家族史或有既往不良孕产史或 超声筛查胎儿结构发现明显异常的孕妇,不得用于非医学 指征相关的性别鉴定。在进行该检测前和检测后, 必须结 合孕妇的临床情况(如胎儿超声检查情况)对孕妇及家属 进行相关的产前遗传咨询。相关检测的开展应符合原卫生 部发布的《产前诊断技术管理办法》的相关规定。在进行 该检测前, 必须与孕妇有充分的知情谈话, 需说明该技术 检测的内容、风险和技术局限性,并签署相关的知情同意 书。 本试剂盒检测结果仅供临床参考,不应作为产前诊断 的唯一依据, 临床医生应结合核型分析、超声检查等检测 结果进行综合判断。阴性结果不能排除其他染色体三体, 其结果的确认应结合临床进行综合判断。
本试剂盒的检测项目应在有产前诊断资质的医疗机构 中开展。项目申请的要求参照我国相关的卫生行业标准。 申请检测的医师应是经过产前诊断专业培训的、有资质的 医师。 本试剂盒对嵌合体样本的检出率较低,当样本为嵌合 体时,会影响本试剂盒检测结果的准确性。 产品说明书中介绍了该产品检验方法的局限性及使用 中的注意事项。
依据《医疗器械监督管理条例》(国务院令第 739 号)、《体外诊断试剂注册与备案管理办法》(国家市场 监督管理总局令第 48 号) 等相关医疗器械法规与配套规 章,经对申请人提交的注册申报资料进行系统评价, 申报 产品符合安全性、有效性的要求,符合现有认知水平,建 议准予注册。该产品预期用途包含 Prader-Willi 综合征 /Angelman 综合征辅助诊断,该疾病为列入罕见病目录的疾 病,按照《用于罕见病防治医疗器械注册审查指导原则》 的相关要求,请申请人于上市后收集临床应用数据,将本 产品检测结果与 Prader-Willi 综合征/Angelman 综合征临 床诊断结论进行对比,应至少收集到 10 例确诊病例,评价 本产品临床性能。相关资料应由临床机构签章, 于产品延 续注册时提交。
2024 年 1 月 4 日
附件:产品说明书
染色体非整倍体及基因微缺失检测试剂盒(可逆末端终止测序法)说明书 【产品名称】 通用名称: 染色体非整倍体及基因微缺失检测试剂盒(可逆末端终止测序法) 【包装规格】 24 测试/盒 【预期用途】 本试剂盒用于体外定性检测孕 18~26 周孕妇的羊水样本中第 13 号、 18 号、 21 号、性 染色体的非整倍体, 以及第 15 号染色体 q11.2-q13 区域的缺失情况。 用于产前筛查高风险孕妇、高龄孕妇、超声检查发现胎儿结构异常且怀疑存在 13、 18、21、X、Y 等染色体数目异常或存在相关染色体微缺失的孕妇, 以及其他具有相关医学 指征的孕妇,进行胎儿 13-三体综合征、 18-三体综合征、 21-三体综合征、特纳综合征、 Klinefelter 综合征、超雌综合征、超雄综合征和 Prader-Willi 综合征/Angelman 综合征 产前辅助诊断。 不适用于有染色体异常家族史或有既往不良孕产史或超声筛查胎儿结构发现明显异常 的孕妇,不得用于非医学指征相关的性别鉴定。在进行该检测前和检测后, 必须结合孕妇 的临床情况(如胎儿超声检查情况) 对孕妇及家属进行相关的产前遗传咨询。相关检测的 开展应符合原卫生部发布的《产前诊断技术管理办法》的相关规定。在进行该检测前, 必 须与孕妇有充分的知情谈话,需说明该技术检测的内容、风险和技术局限性,并签署相关 的知情同意书。 本试剂盒检测结果仅供临床参考,不应作为产前诊断的唯一依据, 临床医生应结合核 型分析、超声检查等检测结果进行综合判断。阴性结果不能排除其他染色体三体, 其结果 的确认应结合临床进行综合判断。 本试剂盒的检测项目应在有产前诊断资质的医疗机构中开展。项目申请的要求参照我 国相关的卫生行业标准。申请检测的医师应是经过产前诊断专业培训的、有资质的医师。 本试剂盒对嵌合体样本的检出率较低,当样本为嵌合体时,会影响本试剂盒检测结果 的准确性。 染色体非整倍体异常是指染色体数目增加或减少一条或多条的现象。染色体异常在新 生儿中的发生率为 5/1000~6/1000[1]。其中常见的染色体非整倍体疾病如下:
基因微缺失是染色体结构变异的一种,15 号染色体 q11.2-q13 区域缺失是典型的致病 性微缺失变异, 其对应综合征分两类为: 1)Prader-Willi 综合征(Prader-Willi Syndrome,PWS), 又称肌张力低下-智力障碍-性腺发育滞后-肥胖综合征, 是由于 15 号染 色体 q11.2-q13 区域父源性印记基因区域缺失引起的一种遗传性疾病。 2)Angelman 综合 征(Angelman Syndrome,AS)又称快乐木偶综合征,是由母源 15 号染色体 q11.2-q13 区 域上的印记基因缺失而引起的。 Prader-Willi 综合征及 Angelman 综合征的发病率约为 1/15000 [3]。上述染色体非整倍体及基因微缺失疾病目前在临床上没有很好的治疗手段, 只能在产前诊断期进行预防。临床上常用的诊断方法为: 通过侵入式取样的方式获得羊 水、绒毛和脐带血等样本,以检测染色体变异情况。临床常用诊断方法有核型分析、荧光 原位杂交(FISH)、染色体微阵列分析(CMA)、基因组拷贝数变异测序技术(CNV-seq) 及细菌人工染色体微球技术(Bobs)等。本产品使用的为基于“可逆末端终止测序法”的 基因组拷贝数变异测序(CNV-seq)技术。 【检验原理】 本试剂盒基于可逆末端终止测序法, 通过对基因组 DNA 进行片段化、末端修复、加 “A ”反应、加接头反应及 PCR 富集, 在 DNA 片段两端连接上已知的通用接头序列, 构 建 DNA 文库,并将文库加载到测序芯片上,通过桥式 PCR 扩增, 使文库的每条序列片段 形成一个簇。在测序反应中加入不同颜色的荧光基团标记碱基,在链的延伸过程中,每个 循环只加入一个正确互补的碱基,根据不同的荧光信号的组合确认碱基的种类,经过多个 循环后,获得序列信息。通过对提取的 DNA 进行测序,并将测得的序列与人类参考基因 组的序列进行比对, 获得序列在染色体上分布的信息。通过数学模型计算比对至参考基因 组上的序列数, 分析第 13 号、 18 号、 21 号、性染色体是否出现非整倍性,以及第 15 号染 色体 q11.2-q13 区域是否缺失,从而实现对胎儿染色体疾病的辅助诊断。
【主要组成成分】 1. 试剂盒组成成分
*不同批号的试剂盒组分不可混用。 2. 试剂盒中不包含但配套使用的试剂及软件 2.1 配套使用的试剂 核酸提取或纯化试剂(天根生化科技(北京) 有限公司, 医疗器械备案号: 京昌械备 20200061 号) 核酸纯化试剂 (安诺优达基因科技(北京)有限公司, 医疗器械备案号:京经械备 20160018 号)
- 20 -
测序反应通用试剂盒(安诺优达基因科技(北京) 有限公司, 规格:75 循环/测试, 1 测试/ 套,医疗器械备案号:京经械备 20160017 号)。 2.2 分析软件 染色体非整倍体及基因微缺失分析软件(安诺优达基因科技(北京)有限公司,型号 ANNO_CHR,版本号 V1)。 2.3 用户自备的其他试剂 无水乙醇(分析纯) 、纯化水 【储存条件及有效期】 储存条件: - 15℃以下储存,有效期 9 个月。各组分开盖后置于- 15℃以下储存,冻融次数 不超过 6 次, 各组分开盖后建议在 3 个月内用完。 生产日期和有效期至:见产品标签。 【适用仪器】 基因测序仪(型号: NextSeq 550AR) (安诺优达基因科技(北京) 有限公司) 【样本要求】 1. 样本类型 孕 18~26 周孕妇的羊水样本。 2. 标本采集和保存 2.1 采集 用螺口离心管、 EDTA 抗凝管或无菌管采集羊水样本,总量不低于 5 mL。 2.2 保存 检测应使用新鲜样本,短期储存时, 样本应保存在 2~8℃条件下,不超过 72h。如不 能及时安排提取,建议采集的羊水样本应在- 15℃以下保存,可保存 2 年。羊水避免反复冻 融。从羊水细胞提取的 DNA,若要长期保存,在- 15℃以下可保存 5 年,若需反复使用, 冻融次数建议不超过 6 次。 【检验方法】 1. 核酸提取 取 2 mL 待测羊水样本,使用推荐的试剂盒进行基因组 DNA 提取,详细的操作步骤参 见该试剂盒说明书。 2. 酶切片段化反应 2.1 对提取获得的样本 DNA 进行浓度检测(推荐使用 Qubit® dsDNA HS Assay Kit,货号 Q32854,生产厂商: Thermo Fisher Scientific Inc), 并用纯化水将其稀释至 1 ng/µL,置于 冰上备用。取出 CAM 阴性对照品、 CAM 阳性对照品 1 、CAM 阳性对照品 2、CAM 阳性 对照品 3 置于室温条件下融化, 振荡混匀,瞬时离心,另取 4 支 1.5 mL 离心管分别加入 9
μL 纯化水, 将上述对照品各取 1 µL 分别加入对应的 1.5 mL 离心管中, 振荡混匀,瞬时离 心,置于冰上备用。 2.2 取出 CAM 片段化缓冲液、 CAM 终止液 1 、CAM 终止液 2,置于室温条件下融化, 振 荡混匀,瞬时离心。 CAM 片段化缓冲液、 CAM 终止液 1 置于冰上备用,CAM 终止液 2 室 温放置。 2.3 取出 CAM 片段化酶, 振荡混匀, 瞬时离心,置于冰上备用。 2.4 在冰上配制酶切片段化反应体系预混液,配制时,先加纯化水和 CAM 片段化缓冲液, 振荡混匀, 瞬时离心,再加入 CAM 片段化酶,酶切片段化反应体系见表 1。 表 1 酶切片段化反应体系
2.5 将配制好的酶切片段化反应预混液振荡混匀,瞬时离心,取 10 μL 酶切片段化反应预混 液,分装到置于冰上的 96 孔 PCR 板(或 1.5 mL 离心管), 振荡混匀,瞬时离心。 2.6 取 10 μL 稀释后的样本 DNA 及对照品加入到分装好的酶切片段化反应预混液中, 加膜 密封(或扣紧管盖) ,振荡混匀,瞬时离心。 2.7 置于恒温金属浴(或 PCR 扩增仪)上进行酶切片段化反应, 酶切片段化反应条件见表 2。 表 2 酶切片段化反应条件
2.8 酶切片段化反应结束后,将样品置于冰上, 瞬时离心, 并立即加入 5 µL CAM 终止液 1,加膜密封(或扣紧管盖),振荡混匀, 瞬时离心,置于冰上,反应 2 分钟。 2.9 将样品从冰上取下, 加入 2.5 µL CAM 终止液 2,加膜密封(或扣紧管盖) 。振荡混 匀,瞬时离心, 室温放置 2 分钟。 2.10 将样本转移至 1.2 mL 96 孔浅孔板(或原 1.5mL 离心管)中,按照核酸纯化试剂的操 作流程(见步骤 7 核酸纯化操作流程), 使用 49.5 µL 纯化磁珠悬浮液进行纯化,纯化过 程轻微吸打,以免产生过多气泡,用 44 µL 纯化洗脱液溶解。 3. 酶反应 1(末端修复反应)
3.1 取出 CAM 缓冲液 1,置于室温条件下融化,振荡混匀,瞬时离心。取出 CAM 酶 1,瞬 时离心。在冰上,配制酶反应 1 体系预混液,反应体系见表 3。 表 3 酶反应 1 体系
3.2 将配制好的酶反应 1 预混液振荡混匀, 瞬时离心。吸取 8 µL 酶反应 1 预混液,分装到 置于冰上的 96 孔 PCR 板(或 1.5 mL 离心管)。 3.3 将 2.10 中纯化后的 DNA 取 42 µL 加入到分装好的酶反应 1 预混液中, 加膜密封(或扣 紧管盖), 振荡混匀,瞬时离心。 3.4 置于恒温金属浴(或 PCR 扩增仪)上,反应条件为 20℃ , 30 分钟。 3.5 酶反应 1 结束后, 将样品取出,瞬时离心。将样本转移到 1.2 mL 96 孔浅孔板(或 1.5 mL 离心管)中,按照核酸纯化试剂的操作流程(见步骤 7 核酸纯化操作流程),使用 75 µL 纯化磁珠悬浮液进行纯化, 用 21.5µL 纯化洗脱液溶解。 4. 酶反应 2(加“A”反应) 4.1 取出 CAM 缓冲液 2,置于室温条件下融化,振荡混匀,瞬时离心。取出 CAM 酶 2,瞬 时离心。 4.2 在冰上配制酶反应 2 体系预混液, 反应体系见表 4。 表 4 酶反应 2 体系
4.3 将配制好的酶反应 2 预混液振荡混匀, 瞬时离心。吸取 5.5 µL 酶反应 2 预混液分装到置 于冰上的 96 孔 PCR 板中(或 1.5 mL 离心管)。 4.4 将 3.5 中纯化后的 DNA 取 19.5 µL 加入到分装好的酶反应 2 预混液中, 加膜密封(或扣 紧管盖), 振荡混匀,瞬时离心。 4.5 置于恒温金属浴 (或 PCR 扩增仪) 上,反应条件为 37℃ , 30 分钟, 反应结束后立即 取下置于冰上, 立即进行下一步反应。 5. 酶反应 3(加接头反应) 5.1 取出 CAM 缓冲液 3,置于室温条件下融化,振荡混匀,瞬时离心。取出 CAM 酶 3,瞬 时离心。 5.2 在冰上,配制酶反应 3 体系预混液,反应体系见表 5。
5.3 将配制好的酶反应 3 预混液振荡混匀, 瞬时离心。吸取 27 µL 酶反应 3 预混液, 分装到 置于冰上的 96 孔 PCR 板(或 1.5 mL 离心管)。 5.4 将 4.5 中酶反应 2 的产物加入到分装好的酶反应 3 预混液中, 加膜密封(或扣紧管 盖), 振荡混匀,瞬时离心。 5.5 置于恒温金属浴(或 PCR 扩增仪)上,反应条件为 20℃ , 15 分钟。 5.6 酶反应 3 结束后, 将样品取出,瞬时离心。将 5.5 步骤中的反应产物转移到 1.2 mL 96 孔浅孔板(或 1.5 mL 离心管), 按照核酸纯化试剂的操作流程(见步骤 7 核酸纯化操作流 程), 使用 78 µL 纯化磁珠悬浮液进行纯化, 用 19 µL 纯化洗脱液溶解。 6. PCR 扩增反应 6.1 取出 CAM-PCR 反应液、CAM 公共引物、 CAM 标签引物(按照样本数量确定需要的标 签引物数量), 置于室温条件下融化,振荡混匀, 瞬时离心。 6.2 在冰上,配制 PCR 反应预混液, 反应体系见表 6 。 表 6 PCR 反应体系
6.3 吸取 4 µL 标签引物加入到置于冰上的 PCR 板(或 PCR 管), 保证加到每个孔的底 部。不同样本需使用不同的标签引物以示区分。24 条标签引物在 96 孔板中的分布见下 表: 1 2 3 4 5 6 7 8 9 10 11 12
备注: 1-24 为标签引物的顺序号。 6.4 将 6.2 中配制好的 PCR 反应预混液振荡混匀,瞬时离心。取 29 µLPCR 反应预混液加入 到置于冰上已加入标签引物的 PCR 板(或 PCR 管)。 6.5 将 5.6 中纯化好的 DNA 取 17 µL 加入到 PCR 板(PCR 管), 加膜密封, 振荡混匀, 瞬 时离心。 6.6 置于 PCR 扩增仪上, PCR 反应条件见表 7。 表 7 PCR 反应条件
6.7 PCR 结束后,将样本取出,瞬时离心。将样本转移到 1.2 mL 96 孔浅孔板(或 1.5 mL 离 心管) ,按照核酸纯化试剂的操作流程(见步骤 7 核酸纯化操作流程) ,使用 45 µL 纯化 磁珠悬浮液进行纯化,用 82 µL 纯化洗脱液溶解。 6.8 吸取 80 µL 洗脱好的 DNA 文库至贴好标签的 1.5 mL 离心管中, - 15℃以下保存。 7. 核酸纯化操作流程 使用配套的核酸纯化试剂按下述步骤进行纯化操作: 7.1 使用无水乙醇与纯化水配制 70%的乙醇备用。 7.2 将核酸纯化试剂中的纯化磁珠悬浮液从 2~8℃取出,室温平衡 30 分钟。 7.3 将纯化磁珠悬浮液涡旋混匀。混匀的标准: 倒置时,管底无磁珠挂壁。 7.4 将纯化磁珠悬浮液分装到 1.2 mL 96 孔浅孔板(或 1.5 mL 离心管) 中。每步酶反应后纯 化的参考体积见表 8。 表 8 每步酶反应后纯化的参考体积
- 25 -
7.5 将 DNA 反应物加入到 7.4 中的浅孔板(或 1.5 mL 离心管)中,用移液器反复吹打 20 次。将纯化磁珠悬浮液与 DNA 反应物充分混匀,室温静置 8 分钟。 注:吹打混匀注意避免产生大量气泡。 7.6 将浅孔板(或 1.5 mL 离心管)转移至磁力架上静置 5 分钟, 待溶液澄清后将上清吸 走,转入废液桶。 7.7 向浅孔板(或 1.5 mL 离心管)中加入 200 μL 70%乙醇,移液器吸打 10 次,避免吹散磁 珠。 7.8 将乙醇吸走,转入废液桶。操作环节不可将浅孔板(或 1.5 mL 离心管) 从磁力架上拿 下或将磁珠吹散。 7.9 重复步骤 7.7 和 7.8 。 7.10 保持浅孔板(或 1.5 mL 离心管)置于磁力架上,室温开盖晾干 2~5 分钟以去除残存的 乙醇, 避免磁珠过分晾干。 7.11 将浅孔板(或 1.5 mL 离心管)从磁力架上取下,加入纯化洗脱液反复吹打 20 次,室 温静置 5 分钟。每次纯化所需加入的纯化洗脱液体积见表 9: 表 9 每次纯化需加入的纯化洗脱液体积
7.12 将浅孔板(或 1.5 mL 离心管)重新放于磁力架上至溶液澄清, 上清即为纯化后的 DNA 产物。 7.13 将上清转移至新的离心管或 PCR 板中, 供下一步反应或检测使用。 7.14 DNA 文库可于- 15℃以下保存半年, 冻融次数建议不超过 6 次。 8. 文库检测 检测 6.8 中收集到文库的浓度, 文库浓度不得低于 10 nmol/L,且文库片段主峰范围在 200~500 bp 之间,不达标应重新建库。 9. 上机测序 DNA 文库经过浓度检测后,使用基因测序仪(型号:NextSeq 550AR)配套测序反应 通用试剂盒,在基因测序仪(型号: NextSeq 550AR)上按照操作说明书进行单端 40+8 循 环测序。 10.生物信息分析
- 26 -
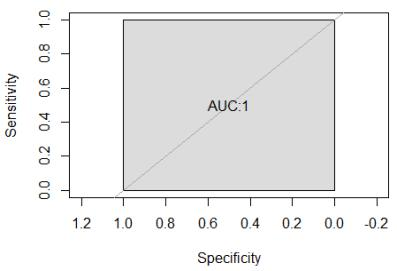
测序完成后,使用“染色体非整倍体及基因微缺失分析软件”对检测数据进行分析,得 到相关检测结果。 【阳性判断值】 1. 13 号、 18 号、 21 号染色体参考值 对 35 例 13 号、 18 号、 21 号染色体三体阳性样本和 145 例 13 号、 18 号、 21 号染色体 三体阴性样本进行检测, 计算其 DV 值,并对其做 ROC 曲线统计分析,如下图:
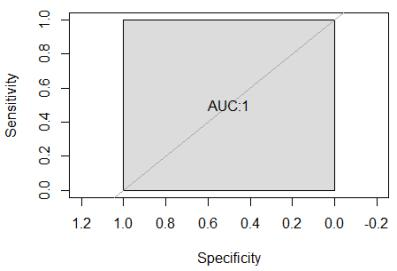
ROC 曲线面积 AUC=1,故根据 DV 值可以很好地区分阳性样本与阴性样本。当检测 阈值设定为 DV=1.1 时,敏感度可达 100%,特异性可达 100%,阴阳性样本能够有效的区 分。据此判定, 当对应染色体(13 号、 18 号、 21 号)的 DV<1.1 时, 样本为该染色体三体 阴性; 当对应染色体(13 号、 18 号、 21 号)的 DV≥1.1 时, 样本为该染色体三体阳性。 通过 80 例 13 号、 18 号、 21 号染色体三体阳性样本和 260 例 13 号、 18 号、 21 号染色 体三体阴性样本的验证结果显示,建立的阳性判断值可准确判断阴性和阳性。 2. 性染色体参考值 对 60 例性染色体非整倍体阳性样本和 120 例性染色体非整倍体阴性样本进行检测, 计 算其 DV 值, 并对其做 ROC 曲线统计分析,如下图:
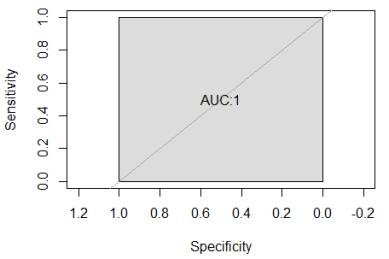
考量阴性群体为正常女性时, 以 46,XX 为阴性样本对照的 ROC 曲线面积 AUC=1,故 根据 DV 值可以很好地区分阳性样本与阴性样本。设定检测阈值为| DV23 - 1|=0.1 且 |DV24 |=0.1 时,敏感度可达 100%,特异性可达 100%,据此判定当(a)0.9< DV23 <1.1 且 DV24<0.1 时,性染色体非整倍体为阴性。 考量阴性群体为正常男性时, 以 46,XY 为阴性样本对照的 ROC 曲线面积 AUC=1,故 根据 DV 值可以很好地区分阳性样本与阴性样本。设定检测阈值为| DV23 -0.5|=0.1 且| DV24- 0.5|=0.1 时,敏感度可达 100%,特异性可达 100%,据此判定当(b)0.4< DV23 <0.6 且 0.4< DV24<0.6 时, 性染色体非整倍体为阴性。 故当(a)0.9< DV23 <1.1 且 DV24<0.1;(b)0.4< DV23 <0.6 且 0.4< DV24<0.6,任一条 件成立,性染色体非整倍体为阴性; 其他情况性染色体非整倍体阳性。 通过 80 例性染色体非整倍体阳性样本和 260 例性染色体非整倍体阴性样本的验证结果 显示, 建立的阳性判断值可准确判断阴性和阳性。 3. 15q11.2-q13 区域参考值 对 37 例 15 号染色体 q11.2-q13 区域缺失的阳性样本和 143 例 15 号染色体 q11.2-q13 区 域缺失的阴性样本计算其 DVcnv 值及 cnv_mark 值,并对其做 ROC 曲线统计分析,如下 图:
- 28 -
当以 cnv_mark<0.2 为区域缺失阳性的质控条件, 使用 DV 值分类时,其 ROC 曲线面 积 AUC=1,且当阈值 DV=- 1 时,敏感度可达 100%,特异性可达 100%,据此判定当 DVcnv≤- 1,且 cnv_mark<0.2 时,表明检测区间存在缺失, 否则,检测区间未检测出缺失。 通过 20 例 15 号染色体 q11.2-q13 区域缺失阳性样本和 320 例 15 号染色体 q11.2-q13 区 域缺失阴性样本的验证结果显示,建立的阳性判断值可准确判断阴性和阳性。 【检验结果的解释】 1. 质控标准 1)文库产出的原始数据量不低于 4.5 M 序列, 如未达标, 则应重新测序;文库 GC 含量应 在 38.5%~45.5%之间,UR_Ratio 不低于 0.6,如未达标,则应重新建库。 2)试剂盒对照品的检测结果应符合理论检测结果: a) CAM 阴性对照品的检测结果要求为 13 号、 18 号、 21 号染色体三体阴性及 性染色体非整倍体阴性, 且 15 号染色体 q11.2-q13 区域缺失阴性; b) CAM 阳性对照品 1 的检测结果要求检出 13 号染色体三体阳性; c) CAM 阳性对照品 2 的检测结果要求检出性染色体非整倍体阳性; d) CAM 阳性对照品 3 的检测结果要求检出 15 号染色体 q11.2-q13 区域缺失阳 性。 如上述对照品不符合理论检测结果, 则该批次检测结果视为无效。 2. 结果判读 1)13 号染色体判断: 当样本 13 号染色体 DV13<1.1 时, 表明该样本未见 13 号染色体三体异常; 当 13 号染 色体的 DV13≥1.1 时,表明该样本为 13 号染色体三体阳性, 提示胎儿具有 13-三体 综合征相关致病变异。 2)18 号染色体判断:
- 29 -
当样本 18 号染色体检测值 DV18<1.1 时,表明该样本未见 18 号染色体三体异常;当 18 号染色体的 DV18≥1.1 时,表明该样本为 18 号染色体三体阳性,提示胎儿具有 18-三体 综合征相关致病变异。 3)21 号染色体判断: 当样本 21 号染色体检测值 DV21<1.1 时,表明该样本未见 21 号染色体三体异常;当 21 号染色体的 DV21≥1.1 时,表明该样本为 21 号染色体三体阳性,提示胎儿具有 21- 三体综合征相关致病变异。 4)性染色体判断: (a)当样本性染色体检测值“DV24<0.1,且 0.9<DV23<1.1” 时,表明该样本未见性染色 体数目异常。 (b)当样本性染色体检测值“0.4<DV24<0.6,且 0.4<DV23<0.6” 时,表明该样本未见性 染色体数目异常。 (c)当样本性染色体检测值为上述两种情况以外的其他情况时,表明该样本为性染色 体非整倍体阳性。提示胎儿具有性染色体非整倍体相关综合征(特纳综合征、Klinefelter 综合征、超雌综合征或超雄综合征等)的致病变异。 当样本存在性染色体非整倍体检出阳性时,几种常见的性染色体非整倍体疾病的染色 体数目,以及与本试剂盒性染色体参考值的对应关系如下表:
备注: 1 、0.1 代表偏离理想值的波动程度;2、对于检测值不在上述四种典型亚型测值 范围内的性染色体非整倍体的阳性样本, 其可能是其他性染色体非整倍体亚型或者嵌合 体。
注:由于男性与女性的性染色体组成存在天然的差异性, 在性染色体异常尤其是发生 嵌合情况时,可能存在同一检测结果数值有多种不同的嵌合体组合形式,因此依靠检测值 进行性染色体非整倍体的亚型区分存在一定的局限性。对于嵌合体的性染色体非整倍体样 本,其检测结果有可能不符合典型亚型区间, 无法进一步分型。当 CNV 检测提示性染色 体异常,但无法判断其是否是嵌合体以及相应细胞系的组成和比例时, 建议进一步进行染 色体核型或 FISH 检测[4] 。
5)15 号染色体 q11.2-q13 区域判断: 当 15 号染色体 q11.2-q13 区域检测值 DVcnv ≤- 1,且 cnv_mark<0.2 时, 表明该样本为 15 号 q11.2-q13 区域微缺失阳性,提示胎儿具有 15 号 q11.2-q13 区域缺失相关综合征
(Prader-Willi 综合征及 Angelman 综合征)的致病变异;当检测结果不满足上述情况时, 表明该样本未见 15 号 q11.2-q13 区域缺失异常。
【检测方法的局限性】 1. 本试剂盒仅用于体外定性检测人羊水样本中第 13 号、 18 号、 21 号、性染色体非整倍 体,以及第 15 号染色体 q11.2-q13 区域的缺失情况。无法检测预期用途以外的扩增、 缺失、点突变、平衡性重排(倒位和易位)、倍性变化、单亲二体和甲基化改变等其 他染色体异常情况。检测结果不作为患者临床诊断的唯一依据,仅供临床参考。 2. 本方法不能检测所有的嵌合体样本, 因为嵌合体检测能力受异常细胞比例的影响, 且 具有区域特异性,不同的检测区域, 可检出的嵌合比例下限不同。 3. 由于男性与女性的性染色体组成存在天然的差异性,在性染色体异常尤其是发生嵌合 情况时,可能存在同一检测结果数值有多种不同的嵌合体组合形式,因此依靠检测值 进行性染色体非整倍体的亚型区分存在一定的局限性。对于嵌合体的性染色体非整倍 体样本,其检测结果有可能不符合典型亚型区间, 无法进一步分型。当检测提示性染 色体异常, 但无法判断其是否是嵌合体以及相应细胞的组成和比例时, 建议进一步进 行染色体核型或 FISH 检测。 4. 母体细胞污染可能会导致错误的分析结果。 5. 本试剂盒不可用于检测单绒毛膜单羊膜囊(MCMA)双胎的孕妇羊水样本。 6. 本试剂盒不可用于检测 100 Kb 以下的微缺失。 【产品性能指标】 1. 企业参考品/国家参考品检测 1.1 阳性参考品符合率(准确性) 采用染色体拷贝数变异检测国家参考品进行检测, 试剂盒检测范围内阳性参考品应全 部检出标注的染色体拷贝数变异,试剂盒检测范围内微缺失微重复阳性参考品,应检出标 注的染色体拷贝数变异, 且结果变异区域坐标与对照方法检测结果的坐标相比较, 交叠区 域(overlap)应在对照方法检测变异区域的 90%以上;或采用企业阳性参考品进行检测, CAM-P1 应检出 13 号染色体三体阳性,CAM-P2 应检出 18 号染色体三体阳性,CAM-P3 应 检出 21 号染色体三体阳性,CAM-P4~P7 应检出性染色体非整倍体为阳性,CAM-P8~P9 应 检出 15 号染色体 q11.2-q13 区域缺失。 1.2 阴性参考品符合率(特异性) 采用染色体拷贝数变异检测国家参考品进行检测, 试剂盒检测范围外阴性参考品(其 他类型染色体非整倍体、染色体微缺失微重复综合征样本和染色体正常样本)全部检出为 阴性; 或采用企业阴性参考品进行检测, CAM-N1~N4 应为 13 号、 18 号、 21 号染色体三 体阴性、性染色体非整倍体阴性,且 15 号染色体 q11.2-q13 区域缺失阴性。 1.3 检测限
a)采用染色体拷贝数变异检测国家参考品进行检测,试剂盒检测范围内微缺失微重复 综合征(30% 嵌合) 阳性参考品,应检出标注的染色体拷贝数变异;或采用企业嵌合体参 考品进行检测, CAM- 131821-30%应全部检出 13 号、 18 号、 21 号染色体三体阳性, CAM- XXX-30% 、CAM-X0-30% 、CAM-XYY-30% 、CAM-XXY-30%应全部检出性染色体非整倍 体为阳性, CAM-AS-30%、CAM-PWS-30%应全部检出 15 号染色体 q11.2-q13 区域缺失。 b)采用染色体拷贝数变异检测国家参考品进行检测,试剂盒检测范围内染色体非整倍 体阳性参考品稀释至不高于试剂盒声称的检测限, 应检出标注的染色体拷贝数变异;或采 用企业检测限参考品稀释至 L1(5ng 起始量) 、L2(10ng 起始量)和 L3(15ng 起始量) 进行检测, 其中 CAM- 13-L1 、CAM- 18-L1 、CAM-21-L1 、CAM-XXX-L1 、CAM-X0-L1、 CAM-XYY-L1 、CAM-XXY-L1 、CAM-AS-L1 、CAM-PWS-L1 可检出或未检出; CAM- 13- L2~L3 应检出 13 号染色体三体阳性; CAM- 18-L2~L3 应检出 18 号染色体三体阳性; CAM- 21-L2~L3 应检出 21 号染色体三体阳性; CAM-XXX-L2~L3 、CAM-X0-L2~L3 、CAM- XYY-L2~L3 、CAM-XXY-L2~L3 应检出性染色体非整倍体阳性;CAM-AS-L2~L3 、CAM- PWS-L2~L3 检出 15 号染色体 q11.2-q13 区域缺失。 1.4 重复性 采用企业阳性参考品 CAM-P1 、CAM-P5 、CAM-P8 分别进行 3 次重复性检测,CAM- P1 应全部检出 13 号染色体三体阳性,CAM-P5 应全部检出性染色体非整倍体阳性,CAM- P8 应全部检出 15 号染色体 q11.2-q13 区域缺失。 2. 最低检测限研究 可检出 10 ng DNA 样品中含量低至 30%的非整倍体阳性变异和基因微缺失阳性变异。 3. 干扰物研究 羊水样本中可能存在的内源性干扰物质为甘油三酯和胆红素。 通过向羊水中添加高浓度甘油三酯、胆红素组分, 研究检测系统的抗干扰能力,结果 显示当羊水中胆红素的添加量≤0.1mg/mL、甘油三酯≤5mg/dL 时对本试剂盒检测结果无影 响; 羊水样本中可能存在的外源性干扰物质为母血细胞和部分样本采集管中含有的 EDTA 成分。 对于母血细胞中的血红细胞及外源 EDTA 干扰成分,通过向羊水中添加红细胞溶液及 EDTA 进行干扰性分析, 结果显示当羊水样本中含有不超过 5%的血红细胞溶液、 EDTA- K2≤3mg/mL 时,对本试剂盒检测结果无影响; 对于母血细胞中的白细胞,因为其含有正常 女性的基因组 DNA,对于胎儿 DNA 的检测信号将造成类似嵌合体表现的干扰,并会导致 男性胎儿性染色体非整倍体检测结果的异常, 导致检测结果不准确,是本产品方法学上已 知的干扰物。 4. 与其他非整倍体及拷贝数变异的交叉反应研究
使用目标阳性样本 T13 、T18 、T21、性染色体非整倍体(代表型:XXY 、XXX、 X0、XYY),以及第 15 号染色体 q11.2-q13 区域缺失样本进行研究,均检测为对应阳性, 未发现不同变异类型阳性样本间检测结果的交叉干扰; 使用试剂盒检测范围外的 T2 、T3、T4、T5 、T6 、T7、T8、T9 、T10 、T11 、T12、 T14 、T15 、T16 、T17 、T20 、T22 、1p36.33-p36.22 缺失、 4p16.3-p15.2 缺失、 4q31.3-q35 缺 失、 5p15.33-p13.3 缺失、 7q11.23 缺失、 8p23.3-p21.3 重复、 11q23.3-q25 缺失、17p12-p11.2 缺失、 22q11.21 缺失样本进行研究, 均未检出错误阳性结果, 未发现交叉干扰。 5. 精密度研究 由三组人员在不同实验室使用三批次试剂盒和不同测序仪对阴性样本、临界阳性样 品、强阳性样品进行检测,阴性符合率 100%,阳性符合率 100%。表明本检测试剂盒精密 度良好。 6. 临床试验 本产品在临床试验机构一共完成 1519 例, 与已上市产品进行对比研究, 阳性符合率 99.53%(95%CI:98.30%,99.87%),阴性符合率 99.82%(95%CI:99.34%,99.95%)。 与核型分析对比,阳性符合率 99.76%(95%CI:98.67%,99.96%), 阴性符合率 99.91% (95%CI:99.48%,99.98%)。 【注意事项】 1. 开始检测前请仔细阅读本说明书全文,检测应在符合临床基因扩增检验实验室要求的 医疗机构内由专业实验室人员操作使用,并严格按照要求进行操作。 2. 实验室配置和试验操作请按照《医疗机构临床基因扩增检验实验室管理办法》和《临 床基因扩增检验实验室管理工作导则》进行; 整个检测过程应严格分区进行:PCR 反 应体系的配制区,标本处理区等,各区使用的仪器、设备、耗材和工作服应独立专 用。 3. 样本的采集、处理、运输和保存均存在一定生物危害。标本的提取必须在生物安全二 级实验室进行, 并于生物安全柜中操作; 试验中接触过样本和对照品的废弃物品(如 吸头) 、扩增完毕的离心管、样本等应进行无害化处理后方可丢弃。 4. 本试剂盒组分中涉及人源 DNA,不具有传染性, 但仍建议将试剂盒使用过程和使用后 的废弃物视为存在潜在的生物安全风险, 须按《病原微生物实验室生物安全管理条 例》的要求,佩戴必要的安全防护用品进行操作, 操作使用后的废弃物须按照医疗废 物物品处置。 5. 不同批号的试剂请勿混用,请在有效期内使用试剂盒。 6. 本品仅用于体外诊断。 【参考文献】
[1] 米中华,周丽,司冬梅.无创 DNA 检测联合超声软标记筛查胎儿染色体异常的应用[J].中国 医学工程,2015,23(6):65-66. [2] 李璞.医学遗传学,第 1 版.北京中国协和医科大学出版社,1991,11:281. [3] 傅俊江,李麓芸.Prader-Willi/Angelman 综合征的分子遗传学研究进展及其基因诊断. 中华 医学遗传学杂志,1999,16(5):337-339. [4] 中华医学会医学遗传学分会临床遗传学组, 中国医师协会医学遗传医师分会遗传病产前 诊断专业委员会, 中华预防医学会出生缺陷预防与控制专业委员会遗传病防控学组. 低深度 全基因组测序技术在产前诊断中的应用专家共识[J]. 中华医学遗传学杂志, 2019, 36(4):4. [5] Zhang H, Zhao Y-Y, Song J, Zhu Q-Y, Yang H, Zheng M-L, Xuan Z-L, Wei Y, Chen Y, Yuan P-B et al: Statistical Approach to Decreasing the Error Rate of Noninvasive Prenatal Aneuploid Detection caused by Maternal Copy Number Variation. Scientific Reports 2015, 5:16106. [6] Du Y, Murani E, Ponsuksili S, Wimmers K: biomvRhsmm: genomic segmentation with hidden semi-Markov model. Biomed Res Int 2014, 2014:910390. 【基本信息】 注册人/生产企业/售后服务单位名称: 安诺优达基因科技(北京)有限公司 住所: 北京市北京经济技术开发区科创六街 88 号院 8 号楼 2 单元 701 室 邮政编码: 100176 联系方式: 生产地址: 北京市北京经济技术开发区科创六街 88 号院 8 号楼 2 单元 301 室;北京市北京 经济技术开发区科创六街 88 号院 6 号楼 1 单元 303 室;北京市北京经济技术开发区科创六 街 88 号院仓库 K14 室 生产许可证编号: 【医疗器械注册证编号/产品技术要求编号】 【说明书核准日期及修改日期】 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||