皕晟百科
ENCYCLOPEDIAS
|
吗啡头发检测试剂盒(荧光免疫层析法)(CSZ2200351)受理号:CSZ2200351
体外诊断试剂产品注册技术审评报告
产品中文名称:吗啡头发检测试剂盒(荧光免疫层析法) 产品管理类别:第三类 申 请 人 名称: 杭州莱和生物技术有限公司
国家药品监督管理局 医疗器械技术审评中心
目 录
杭州莱和生物技术有限公司 浙江省杭州市滨江区西兴街道庙后王路 425 号 1 号楼 1-3 层、 401-406 室 杭州市滨江区西兴街道庙后王路 425 号 1 号楼 1-3 层、401-404 室
( 一)产品主要组成成分 试剂盒包含测试卡、毛发处理液,还包含 ID 卡、一次性滴管、干 燥剂。(具体内容详见产品说明书) 说明:不同批次试剂中 ID 卡、测试卡和毛发处理液不能够互换使 用,以免产生错误结果。 (二)产品预期用途 本产品用于体外定性检测人体头发样本中最低检出限为 0.2ng/mg 的吗啡或相当量的结构类似物。 用于在有资质的医疗机构中对 6 个月内是否有吗啡药物滥用的初 筛检测。需要进一步确认及评价的样本应采用灵敏度和特异性更高的 检测方法进行。 (三)产品包装规格 卡型:20 人份/盒,25 人份/盒,40 人份/盒,50 人份/盒,100 人 份/盒。 (四)产品检验原理 采用特异性的抗体抗原反应及免疫层析分析技术,通过抗体竞争 结合特异性抗原和头发中可能含有的被检测物的原理。试纸条含有被 事先固定于膜上测试区(MOP)的特异性吗啡抗原,毛发处理液中含 有抗特异性小鼠抗吗啡 IgG 单克隆抗体荧光标记物和荧光标记兔 IgG多克隆抗体。 测试时,将待测样本用毛发处理液充分裂解后加入试剂盒加样孔 (S)内, 随之在毛细效应下向上层析。如样本中的药物浓度低于临界 值或者没有待测药物时,荧光标记的特异性抗体不能被样本中的药物 全部结合,荧光标记的抗特异性鼠抗吗啡 IgG 单克隆抗体在层析过程 中会被固定在测试区(T)上的特异性抗原结合,则在测试区(T)内出 现较强的荧光信号。如样本中的药物浓度高于临界值时,荧光标记的 特异性抗体被样本中的药物结合,在测试区内(T)上的特异性抗原结 合部分或没有可以结合的特异性抗体,则测试区内(T)出现微弱的荧 光信号或者没有荧光信号。无论待测样本中是否存在待测药物,层析 过程都会将毛发处理液中的荧光标记兔 IgG 多克隆抗体带到质控区内 (C)与山羊抗兔 IgG 多克隆抗体结合。通过干式荧光免疫分析仪读 数,可检测出样本中是否含有待检测药物。 (一)主要原材料 1.主要原材料的选择 本产品的主要原材料包括包被用吗啡抗原(MOP-BSA)、荧光标 记吗啡单克隆抗体、羊抗兔 IgG、荧光标记兔 IgG、硝酸纤维素膜等。 主要原材料均为外购。申请人对主要原材料进行了供应商的选择, 通过功能性试验,筛选出合格供应商,制定了主要原材料的质量标准 并经检验合格。 2.企业参考品的设置情况 申请人设计了完整的企业参考品,包括阳性参考品、阴性参考品、 重复性参考品和最低检出限参考品。 企业参考品由未吸毒人员头发、标准品制备而成。阳性参考品 P1 ~P3 均使用阴性头发萃取液作为基质,添加相应标准品制备而成; 阴性参考品 N1 ~N18、N20 ~N22 涵盖未吸毒人员头发及使用阴性头 发萃取液作为基质、添加相应标准品制备成的样本,其中包含易引起 干扰的结构类似物、常见滥用药物等的样本;重复性参考品 R1、R2 均 使用阴性头发萃取液作为基质,添加相应标准品制备而成;最低检出 限参考品 C1 ~ C3 均使用阴性头发萃取液作为基质,添加相应标准品 制备而成,其中 C1 为阴性。 (二)生产工艺及反应体系研究 申请人对试剂盒反应体系的研究包括加样体积的研究、样本量的 研究、萃取时间的研究、反应时间的研究、毛发处理液体积的研究、 样本与药物滥用时间关系研究等。通过功能性试验,最终确定了最佳 的反应体系。 申请人根据试剂盒中试剂及组件的主要生产工艺的研究结果,确 定了最佳的生产工艺。 (三)分析性能评估 本产品分析性能评估内容主要包括:适用的样本类型、与参考方 法的比对、精密度、最低检出限、分析特异性、高剂量钩状效应研究 等。申请人提交了有效运行的质量管理体系下生产的三批试剂在适用 机型上的性能评估资料。 在适用的样本类型研究中,申请人对吗啡阳性头发样本和阴性头 发样本进行检测,通过与参考方法的检测结果进行比对,表明头发样 本适用于本产品的检测。 在与参考方法的比对中,申请人采用三批试剂,对临床阴性和阳 性样本进行检测, 同时还检测了添加易引起交叉的类似物的样本,结 果与对比方法的符合率均大于 90%,表明申报试剂检测结果与对比方 法 LC-MS/MS 的一致性好。 精密度研究是通过使用三批试剂对企业阳性参考品(P1 )、企业 最低检出限参考品(C1-C3 )、企业阴性参考品(N1、N2、N9、N10) 和不同浓度水平临床样本,进行重复检测,企业参考品每份样本重复 检测 10 次,临床样本每份重复检测 3 次,由三位操作者在不同的试验 地点用不同批次的试剂分别对上述样品进行连续 20 天的检测。结果表 明:本产品的重复性、再现性满足 CV≤15%的要求。 在最低检出限研究中,申请人采用三批试剂,检测阴性头发样本 和不同浓度梯度的标准品,包括其他常见结构类似物的标准品,分别 重复检测 20 次,将检测结果均为阳性的最低浓度定为本产品的最低检 出限,并使用临床样本进行最低检出限验证。最终确定该产品检测的 最低检出限为 0.2 ng/mg 吗啡或相当量的结构类似物。 在分析特异性中,申请人采用三批试剂,对企业阴性参考品、阳 性参考品进行检测,每份样本检测 10 次,所有结果均符合要求。 在干扰试验中,分别使用阴性和阳性头发样本,对市面上主流的 28 种洗护美发产品、内源性物质(如: 头皮屑、油脂)的干扰以及 36 种常见心血管治疗药物、降糖药、抗生素、抗病毒和解热镇痛药物的 干扰进行研究。结果表明:国内常见洗发美发用品,如潘婷、海飞丝、 蜂花等洗发乳、护发素、发胶、发蜡等对产品检测结果无影响,魔香 弹力素、bed head 弹力素、沙宣弹力素浓度大于 3 mg/ml 时可能会导 致结果阳性, 内源性物质及常见药物对试剂盒的检测无影响。取经烫 发、染发、漂染的阴性和阳性头发为检测样本进行检测,与 LC-MS/MS 检测结果进行比较,结果一致。 在交叉反应研究中,申请人采用三批试剂,对常见成瘾药物、常 见戒毒药物和结构类似物进行检测。经验证本试剂与 500 ng/mg 的甲 基安非他明、氯胺酮、伪麻黄碱、苯甲酰爱康宁、地西泮、苯巴比妥、 美沙酮、雷尼替丁、普鲁卡因、曲马多、麻黄碱、加替沙星、四氢大 麻酚酸、丁丙诺啡、250 ng/mg 纳洛酮无交叉。 在高剂量钩状效应研究中,申请人采用三批试剂,对一系列浓度 的吗啡标准品进行检测,每个浓度点检测 3 次,结果表明:直至标准 品浓度为 1 mg/mL,试剂检测结果仍正常,未出现钩状效应。 (四)阳性判断值研究 本研究分为阳性判断值建立和验证两部分。阳性判断值的建立是 根据 55 例吗啡阳性头发样本、200 例阴性头发样本的检测结果,通过 建立 ROC 曲线,来确定试剂盒的阳性判断值。然后再使用三批成品试 剂盒,检测吗啡阳性头发样本和阴性头发样本,经验证,莱和试剂检 测结果与对比方法检测结果具有高度一致性,本产品检测吗啡的阳性 判断值为 0.2 ng/mg。
申请人对产品的实时稳定性、运输稳定性、开封稳定性、及样本 稳定性进行了研究。 实时稳定性:将三批试剂置于规定储存条件下放置 0 、3 、6 、9、 12 、18 、24 、30 、31 个月,毛发处理液保存在 2~8℃的条件下,每一 时间节点使用阴、阳性对照品及阴、阳性头发样本,对试剂盒的性能 进行检测,结果表明产品测试卡和 ID 卡在 4~30℃储存的有效期为 24 个月,毛发处理液在 2~8℃存放的有效期为24 个月。 此外,申请人对产品的运输稳定性、使用稳定性和样本稳定性分 别进行了研究。结果显示,产品的性能均能满足产品说明书的声称。 申请人在武汉市精神卫生中心、桂林市人民医院、湖南省脑科医 院(湖南省第二人民医院)共 3 家机构完成了临床试验。采用试验体 外诊断试剂与液相色谱-串联质谱法(LC-MS/MS)进行比较研究试验, 确认本产品的临床性能。共纳入病例 709 例,入组人群应为疑似药物 滥用人群,同时纳入其他药物滥用的交叉反应病例以及服用常见药物 的潜在干扰病例,样本类型为头发。其中,452 例阳性样本,257 例阴 性样本。试验结果显示,试验体外诊断试剂与对比方法对于吗啡检测 的阳性符合率为 99.1%(95%CI:97.8%,99.8%),阴性符合率为 97.7% (95%CI:95.0%,99.1%),总符合率为 98.6%(95%CI:97.4%,99.3%)。 以上结果显示两者检测结果之间具有良好的一致性。 综上所述,申报产品的临床试验资料符合技术审评要求。
本产品根据 YY/T 0316-2016 医疗器械风险管理对医疗器械产品 的安全风险分析方式,对本产品进行风险分析。 ( 一) 受益评估 本产品用于体外定性检测人体头发样本中最低检出限为 0.2 ng/mg 的吗啡或相当量的结构类似物,用于吗啡的初筛检测,为临床 提供了一种更多的吗啡初筛检测方法。 (二) 风险评估 申请人对已知危险(源)进行风险评价,按照风险可接受准则判 断每个危险(源) 的风险是否达到可接受水平,对合理可行降低的风 险、不经过风险/收益分析既判定为不可接受的风险采取控制措施,并 对具体措施进行实施验证,同时重新对采取措施后的风险进行估计, 确认其风险水平是否可接受。为保证产品使用安全,基于对主要剩余 风险的规避,需要在产品说明书中提示以下信息: ( 1 )本产品仅用于在有资质的医疗机构中对6个月内是否有吗啡 药物滥用的初筛检测。需要进一步确认及评价的样本应采用灵敏度和 特异性更高的检测方法进行。 (2)产品说明书中介绍了该产品检验方法的局限性及使用中的注 意事项。
本申报项目为境内第三类体外诊断试剂产品注册。申请人的注册 申报资料符合现行要求,依据《医疗器械监督管理条例》(国务院令 第 739 号)、《体外诊断试剂注册与备案管理办法》(国家市场监督 管理总局令第 48 号)等相关医疗器械法规与配套规章,经系统评价后, 建议准予注册。
2024 年 10 月 18 日
附件:产品说明书
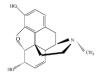
吗啡头发检测试剂盒(荧光免疫层析法)说明书 【产品名称】 通用名称:吗啡头发检测试剂盒(荧光免疫层析法) 【包装规格】 卡型:20 人份/盒,25 人份/盒,40 人份/盒,50 人份/盒,100 人份/盒。 【预期用途】 本产品用于体外定性检测人体头发样本中最低检出限为 0.2ng/mg 的吗啡或相当 量的结构类似物。 用于在有资质的医疗机构中对 6 个月内是否有吗啡药物滥用的初筛检测。需要 进一步确认及评价的样本应采用灵敏度和特异性更高的检测方法进行。 吗啡: 属于阿片类生物碱, 是鸦片类毒品的重要组成部分, 其分子式为 C17H19NO3,结构式为 作用,故在医学上作为麻醉性镇痛药,过量使用会造成急性中毒,极易产生耐受性 和成瘾。 毒品进入人体后在血脂酶的作用下代谢,进入肝脏后进一步代谢,有相当量的 毒品及代谢物进入头发中,多与黑色素等结合存在于毛发髓腔内[1]。头发分析已经成 为药物滥用检测的一个可选择又可补充的手段,一般吸食 7 天后,尿液、血液和唾 液中的毒品基本代谢干净,头发相比体液分析有更多的优点:样本收集容易,不受 检测时间限制,室温下即可保存;检测窗较长(从 1 周到数月);头发分析能提供 长期接触的累积图像[1,2,3]。 【检验原理】 莱和吗啡头发检测试剂盒(荧光免疫层析法)采用特异性的抗体抗原反应及免 疫层析分析技术,通过抗体竞争结合特异性抗原和头发中可能含有的被检测物的原 理。试纸条含有被事先固定于膜上测试区(MOP)的特异性吗啡抗原,毛发处理液 中含有抗特异性小鼠抗吗啡 IgG 单克隆抗体荧光标记物和荧光标记兔 IgG 多克隆抗体。 测试时,将待测样本用毛发处理液充分裂解后加入试剂盒加样孔(S)内,随之 在毛细效应下向上层析。如样本中的药物浓度低于临界值或者没有待测药物时,荧 光标记的特异性抗体不能被样本中的药物全部结合,荧光标记的抗特异性鼠抗吗啡 IgG 单克隆抗体在层析过程中会被固定在测试区(T)上的特异性抗原结合,则在测 试区(T)内出现较强的荧光信号。如样本中的药物浓度高于临界值时,荧光标记的特 异性抗体被样本中的药物结合,在测试区内(T)上的特异性抗原结合部分或没有可 以结合的特异性抗体,则测试区内(T)出现微弱的荧光信号或者没有荧光信号。无 论待测样本中是否存在待测药物,层析过程都会将毛发处理液中的荧光标记兔 IgG 多克隆抗体带到质控区内(C)与山羊抗兔 IgG 多克隆抗体结合。通过干式荧光免疫 分析仪读数,可检测出样本中是否含有待检测药物。 【主要组成成分】
A 盒 (1) 测试卡由试纸条、试剂板组成。试纸条上的主要成分有: 硝酸纤维素膜、 吸水纸、塑料片材及其他试纸条支持物;硝酸纤维素膜上包被有合成吗 啡抗原和山羊抗兔 IgG 多克隆抗体。 (2) ID 卡:1 枚/盒 (3) 一次性滴管:用于加样的塑料滴管,每人份 1 支 (4) 干燥剂:二氧化硅干燥剂,每人份 1 袋。 B 盒 毛发处理液:主要由小鼠抗吗啡单克隆抗体荧光标记物、兔 IgG 多克隆抗体荧 光标记物、磷酸盐缓冲液、表面活性剂 S9 组成。 说明:不同批次试剂中 ID 卡、测试卡和毛发处理液不能够互换使用,以免产生错误 结果。 需要但不提供: 头发专用剪刀、记号笔、一次性橡胶手套、称量纸、酒精棉片、样本袋。 【储存条件及有效期】 测试卡于 4~30℃避光保存,禁止冷冻,有效期 24 个月;毛发处理液于2~8℃ 避光保存,有效期 24 个月。 检测前先将检测试剂、 冷藏的毛发处理液 、ID 卡和待测样本恢复到室温 (15-30℃) , 试剂、毛发处理液恢复至室温后开封,开封后 1 个小时内应尽快使用。 生产日期及有效期见包装标签。 【适用仪器】 杭州莱和生物技术有限公司生产的干式荧光免疫分析仪(型号:FA-LF100B)。 【样本要求】 本试剂检测的毛发样本为头发。 头发样本的采集:参照《涉毒人员毛发样本检测规范》(公禁毒【2018】938 号) 进行收集。 样本的采集: 1.工作人员佩戴一次性手套; 2.使用医用剪刀或者锯齿剪刀紧贴被提取人员头皮表面剪取头顶后部(如头顶后 部无法提取到足够头发的,可选择离该部位最近的头部部位)长度为 3 厘米以内的 头发;长于 3 厘米的头发,需从发根端截取 3 厘米。 3.采集样本不少于 5mg。 样本的保存: 采集的头发样本放置于样本袋内封装,样本袋应当置于 4-40℃、避光、干燥、 通风、洁净的环境中保存,不得和易挥发的试剂和药品在同一房间内保存,保存时 间不得超过一年。 注意: 1. 因枕部的头发生长速率变化小,处于生长期的头发多,且较少受到种族以及 性别影响,所以头发最佳采集部位为枕部。 2. 所采头发平放于清洁纸上,标记发根位置及来源部位,以便对检测结果进行 合理的解释。如不需要立即检测可将头发包裹、折叠后,置于袋中。 3. 采集不同人员头发时,应当分别采集,独立包装,统一编号,并及时清理采 样过程中提取器材上的残留物,确保样本不被交叉污染。 4. 头发采集过程需在合理的管控下进行,避免样品混淆。 【检验方法】 使用前请仔细阅读本使用说明书以及杭州莱和生物技术有限公司的干式荧光免 疫分析仪使用说明书。 1. 准备:打开杭州莱和生物技术有限公司的干式荧光免疫分析仪; 2. 检测前先将检测试剂、冷藏的毛发处理液、ID 卡和待测样本恢复到室温 (15-30℃),建议试剂、毛发处理液恢复至室温后开封; 3. 试剂信息核对:确认 ID 卡、试剂的批号、毛发处理液的批号是否都匹配,无 误后插入 ID 卡,在进入测试界面点击读 ID 卡,校准完成,即可检测试剂; 4. 在干式荧光免疫分析仪上的样本类型选项中选择“毛发”模式。 5. 加样 取待检测头发 5mg,剪碎(长度不大于 5mm)或碾碎置于对折的称量纸上, 将碎的头发倒入装有毛发处理液的瓶子内,盖紧瓶盖,震荡混匀 1~2 分钟后,静 置 1 分钟。用滴管吸取毛发处理液的上清,滴加 2 滴(75μL)在试剂板的加样 孔中。处理后的毛发处理液上清请立即使用。 6. 试剂卡加样后需反应 3 分钟,立即读数,超过 5 分钟后读取的结果为无效。 ① 标准测试:试剂卡加样后立即将插入仪器中,然后点击“测试”按钮,系统自 动进行倒计时,并自动读卡给出测试结果。 ② 即时测试:试剂卡加样后机外反应 3min,反应结束后立即将试剂卡插入仪器 中,点击“测试”按钮,系统将自动读卡并给出测试结果。 7. 点击“打印”,系统将自动将测试结果打印在打印纸上。 8. 将检测后的试剂卡,多余的处理液,加样后滴管及多余的临床样本进行处理。 注意:本产品只用于初筛检测使用,检测结果不能作为确诊依据,必须使用第 二种分析方法以确定结果,液相色谱-串联质谱法(LC-MS/MS)是目前较好的确认 分析方法。 【阳性判断值】 根据毛发分析协会(the Society of Hair Testing ,SOHT)关于滥用物质毛发分析 的阈值的描述和司法鉴定技术规范《毛发中 15 中毒品及代谢物的液相色谱-串联质谱 检验方法》(SF/Z JD0107025-2018)的描述:非吸毒人群:毛发中吗啡的浓度< 0.2ng/mg。 本产品能够检出头发样本中高于 0.2ng/mg 的吗啡或相当量的结构类似物。 【检验结果的解释】 1. 本试剂可以检测出 0.2ng/mg 的吗啡或相当量的结构类似物,检测结果阳性表示怀 疑受试者在 1 周-6 个月内吸食过吗啡或结构类似物,检测结果阴性表示受试者可能 在 1 周-6 个月内未吸食过吗啡及结构类似物。 2. 本试剂适用机型为杭州莱和生物技术有限公司生产的干式荧光免疫分析仪(型号: FA-LF100B)。 3. 试剂及其组件仅适用于杭州莱和生物技术有限公司生产的干式荧光免疫分析仪, 否则将导致错误结果。 4. 试剂拆开后应立即使用,否则暴露在空气中时间过长可能导致失效。 5. 测试结果应在加样后 3 分钟时读取,超过 5 分钟以后读取的结果可能发生错误。 6. 检测结果为阴性不代表被测者没有吗啡药物滥用,可能因为被测者药物滥用时间 不在所采集头发的生长期内。 【检验方法的局限性】 1. 本试剂盒仅限于体外诊断用。仅适用于检测人体头发中是否含有吗啡。 2. 本试剂只用于初筛检测使用,检测结果不能作为确认药物滥用的依据。为确保结 果的准确性,必须使用灵敏度和特异性更高的参考分析方法以确定结果。 3. 加样量过多或过少,都可能导致检测结果出现假阳或假阴。 4. ID 卡批号、试剂批号、处理液批号不匹配时将导致错误结果。 5. 如被测者头发使用发胶、啫喱等产品或染发、烫发、漂发,都可能导致出现错误 的结果。 【产品性能指标】 1、用国家标准物质配制成企业参考品, 使用企业参考品进行检测,结果应符合企业 参考品的要求: 1)最低检测限:检测企业最低检测限参考品 C1-C3,最低检测限应不高于 0.2ng/mg。 2)阳性参考品符合率:检测企业阳性参考品 P1-P3,结果应均为阳性。 3)阴性参考品符合率:检测企业阴性参考品 N1-N18 、N20-N22,结果应均为阴性。 4)重复性:检测企业重复性参考品 R1 、R2,结果应均为阳性。 2、本产品能够检出头发样本中高于 0.2ng/mg 的吗啡,经验证最低检出限和最低检出 限浓度附近样本检出率不低于 95% 。可检出 0.25ng/mg 的 O6 单乙酰吗啡、0.5ng/mg 的可待因、0.25ng/mg 的海洛因。 3、精密度:使用三批试剂,对阴、阳性及最低检出限参考品和临床样本进行检测, 每份参考品重复 10 次,临床样本每份重复 3 次,检测结果均符合要求,产品的重 复性好;由三位操作者在不同的试验地点在 20 天中分别使用不同批号试剂检测阴、 阳性及最低检出限参考品和临床样本,检测结果均符合要求,产品再现性好。 4 、分析特异性: 4.1. 吗啡交叉反应 经验证吗啡头发检测试剂与 500ng/mg 的甲基安非他明、氯胺酮、伪麻黄碱、苯 甲酰爱康宁、地西泮、苯巴比妥、美沙酮、雷尼替丁、普鲁卡因、曲马多、麻黄碱、 加替沙星、四氢大麻酚酸、丁丙诺啡、250ng/mg 纳洛酮无交叉。 4.2 .干扰研究 经验证 100μg/mL 的依那普利、硝苯地平、美托洛尔、氢氯噻嗪、哌唑嗪、辛 伐他汀、阿司匹林、尿激酶、维拉帕米、阿托品、去甲肾上腺素、瑞格列萘、胰岛 素、格列本脲、阿卡波糖、盐酸二甲双胍、罗格列酮、青霉素钠、螺旋霉素、链霉 素、头孢菌素、阿奇霉素、林可霉素、两性霉素 B、放线菌素 D、环孢霉素、环氧 沙星、无环茑苷、金刚烷胺、左旋咪唑、转移因子、对乙酰氨基酚、吲哚美辛、布 洛芬、美洛昔康、保泰松,这些常见心血管治疗药物、降糖药、抗生素、抗病毒和 解热镇痛药物对本产品检测结果没有干扰。 头屑(人头皮角质细胞)、头部油脂分泌物对本产品检测结果没有干扰。 国内常见洗发美发用品,如潘婷、多芬、海飞丝、蜂花等洗发乳、护发素、发 胶、发蜡等对产品检测结果均无影响。部分品牌的弹力素对结果产生影响,如:魔 香弹力素、bed head 弹力素、沙宣弹力素。 由于头发洗、护、染等品牌太多,无法一一试验,故不能完全排除所有洗护用 品的干扰。如怀疑假阳性,建议先对样品进行充分清洗,再重新试验。 5、临床试验: 申请人在 3 家临床试验机构完成了临床试验,采用本产品与液相色谱 -串联质谱法(LC-MS/MS)进行比较研究试验,共纳入病例 709 例头发样本,其中 452 例阳性样本,257 例阴性样本。试验结果显示, 本产品与对比方法的阳性符合率 为 99.1%,阴性符合率为 97.7%,总符合率为 98.6%。 【注意事项】 1. 头发样本采集:贴紧头皮剪取,将采集的头发平放于样本袋中。 2. 本品为一次性使用体外诊断试剂,请勿重复使用,过期产品请勿使用。 3. 在收集、处置、储存、混匀样本和检测过程中应采取适当的保护措施。 4. 产品在使用前请不要开封,不要使用有明显损坏的试剂盒、包装有破损的测 试卡。 5. 测试卡及其组件仅适用于杭州莱和生物技术有限公司的干式荧光免疫分析仪 上。 6. 切勿把表面被其它液体沾湿的的测试卡插入检测仪,否则会污染或损坏仪器。 用过的测试卡请妥善处理,不要随意丢弃。 7. 应避免实验环境温度过高,低温保存的测试卡需要恢复至室温后再打开,以 免吸潮。 8. 测试卡和干式荧光免疫分析仪上在使用时应避开颤动和电磁环境;在正常使 用中仪器本身颤动属正常现象;检测进行时请勿拔出 ID 卡。 9. 铝箔袋内有干燥剂,不得内服。 10. 最终的确诊应由医生或专业人士综合各检指标及临床症状后作出。 11. 如检测结果为阳性,建议清洗后,再次进行检测,清洗方法见《毛发中 15 中毒品及代谢物的液相色谱-串联质谱检验方法》(SF/Z JD0107025-2018)。 12. 使用本试剂过程中如有问题或建议,请与厂家联系。 13. 由于方法学或抗体特异性等原因,使用不同生产商的试剂对同一份样本进行 检测可能会得到不同的检测结果,因此用不同试剂检测所得结果不应直接相互比 较,以免造成错误的医学解释。 14. 接触到的临床样本、实验废弃物、 一次性使用物品等材料应当作为潜在传染 物进行处理,并且采用符合法规的预防措施。 【参考文献】 1. 黄丽,毛发中海洛因及其代谢物的分析综述[J],刑事技术,2003,3 :39-42. 2. 叶海英等,LTQ-Orbitrap 组合式高分辨质谱法快速筛查毛发中 7 种毒品及代 谢物[J],分析化学研究报告,2012 ,40(11):1674-1679. 3. 苗翠英,吴洋,毛发中毒品分析[J],刑事技术,2006 ,1:32-35. 【基本信息】 注册人/生产企业名称:杭州莱和生物技术有限公司 住所:浙江省杭州市滨江区西兴街道庙后王路 425 号 1 号楼 1-3 层、401-406 室 联系方式: 传真号码: 网址: 售后服务单位名称: 联系方式: 传真号码: 网址: 生产地址:杭州市滨江区西兴街道庙后王路 425 号 1 号楼 1-3 层、401-404 室 生产许可证编号: 【医疗器械注册证编号/产品技术要求编号】 【说明书核准日期及修改日期】 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||