皕晟百科
ENCYCLOPEDIAS
|
幽门螺杆菌23SrRNAgyrA基因突变检测试剂盒(荧光PCR熔解曲线法)(CSZ2400025)
受理号:CSZ2400025
体外诊断试剂产品注册技术审评报告
产品中文名称:幽门螺杆菌 23SrRNA/gyrA 基因突变检测试剂盒 (荧光 PCR 熔解曲线法) 产品管理类别:第三类 申 请 人 名称: 江苏健为诊断科技有限公司
国家药品监督管理局 医疗器械技术审评中心
目 录
江苏健为诊断科技有限公司 泰州市药城大道五期厂房 G131 号楼 2-3 层 泰州市药城大道五期厂房 G131 号楼 3 层
( 一)产品主要组成成分 试剂盒包含 DNA 聚合酶(MC)、Hp-PCR 预混液(MC)、Hp-野 生型对照(MC)、Hp-阴性对照(MC)。 (具体内容详见产品说明 书) (二)产品预期用途 本产品用于定性检测幽门螺杆菌阳性患者正常粪便样本中幽门螺 杆菌 23S rRNA 基因 A2142G 、A2142C 、A2143G 突变和 gyrA 基因 A260T 、C261A 、T261G 、G271A 、G271T 、A272G 突变。结果只对样 本是否存在突变进行判断,不具体区分突变位点。 本产品通过检测幽门螺杆菌 23S rRNA 基因 2142、2143 位点和 gyrA 基因 87、91 号密码子的突变,为临床医生评估个体中幽门螺杆菌的耐 药特性提供参考。具体检测的突变位点与耐药类型的关系详见表 1。
表 1 可检测的幽门螺杆菌 23S rRNA 和 gyrA 基因突变类型
(三)产品包装规格 48 测试/盒 (四)产品检验原理 本产品采用荧光 PCR 熔解曲线法,其基本原理为: 1 )根据耐药 基因突变位置上下游序列设计 PCR 扩增引物,并根据耐药基因突变设 计荧光探针;2)通过不对称 PCR 扩增,生成与荧光探针杂交的单链 寡核苷酸序列;3 )PCR 扩增完成后,在熔解曲线分析过程中实时检 测反应体系荧光信号强度的变化,从而绘制反应体系的熔解曲线,并 可确定该熔解曲线的熔点(Tm 值),由此推断该序列的突变信息。 (一)主要原材料 1.主要原材料的选择 试剂盒主要原材料包括: 引物、探针、TaqDNA 聚合酶、dNTPs、 幽门螺杆菌 DNA 、293 T 细胞基因组 DNA 等。 主要原材料均为外购方式获得。引物、探针为申请人自行设计后 由专业的合成公司合成。 申请人对主要原材料进行了供应商的选择,
通过功能性试验,筛选出合格供应商,制定了主要原材料的质量标准 并经检验合格。 2.企业参考品和质控品的设置情况 企业参考品包括阳性参考品、阴性参考品、最低检测限参考品、 精密度参考品。阳性参考品 9 份, 由突变型幽门螺杆菌菌株、阴性粪 便样本组成,涵盖该产品可检出的所有突变型;阴性参考品 11 份,由 特异性评价用菌株/人基因组 DNA 和野生型幽门螺杆菌的粪便样本组 成,涵盖常见的种属相近的或引起症状相似的病原体,及人基因组 DNA;最低检测限参考品 18 份,为检测限浓度样本,由突变型幽门 螺杆菌菌株、野生型幽门螺杆菌菌株、阴性粪便样本组成,涵盖该产 品可检出的所有突变型;精密度参考品 9 份,为弱阳性样本,由突变 型幽门螺杆菌菌株、阴性粪便样本组成,涵盖该产品可检出的所有突 变型。 试剂盒包含 1 份 Hp-野生型对照(MC)和 1 份 Hp-阴性对照(MC), 用于检测过程的质量控制。Hp-野生型对照(MC) 由幽门螺杆菌野生 型菌株 DNA 、293T 细胞基因组 DNA 、TE 缓冲液构成,Hp-阴性对照 (MC)由 293T 细胞基因组 DNA 、TE 缓冲液构成。 (二)生产工艺及反应体系研究 申请人通过对试剂主要生产工艺的研究,确定了最佳生产工艺。 申请人通过对引物浓度、探针浓度、TaqDNA 聚合酶浓度、dNTPs 浓 度、镁离子浓度、PCR 反应体系的体积、样本类型、样本采集方式和 采集量、样本处理方式、模板加入量、PCR 扩增反应程序等条件进行
筛选和优化,通过功能性试验,最终确定了最佳的反应体系。 (三)分析性能评估 本产品分析性能评估内容主要包括:核酸提取试剂性能研究、准 确度、重复性、精密度、分析特异性、分析灵敏度等。申请人提交了 有效运行的质量管理体系下的试剂批次在适用机型上的性能评估资 料。 针对核酸提取试剂性能研究,申请人采用临床样本平行比较了三 款核酸提取或纯化试剂的提取性能,最终确定核酸提取试剂为该产品 的配套提取试剂。 准确度评估中,申请人在适用机型上使用三批试剂盒对若干份临 床样本进行检测,检测结果的符合率均为 100%。 精密度评估中,申请人在适用机型上使用三批试剂盒对中阳性, 弱阳性以及阴性样本进行检测,从样本提取开始进行。为期至少 20 天的连续检测,从多变量控制来分析本试剂盒的批内、批间、室内、 室间、人间等因素对产品重复性的影响。三批试剂盒对临床样本的精 密度检测结果均符合要求,批内批间精密度、日内日间精密度、人间 精密度、室间精密度 CV(%)值≤5%。 分析特异性评估中,申请人在适用机型上使用三批试剂盒对具有 同源性核酸序列、易引起相同或相似的临床症状、采样部位正常寄生 或易并发的其他病原体(空肠弯曲菌、萎缩芽孢杆菌、埃希氏大肠杆 菌、阴沟肠杆菌、普通变形杆菌、白色念珠菌、屎肠球菌、铜绿假单 胞菌、金黄色葡萄球菌、乳酸乳球菌、短双歧杆菌、脆弱拟杆菌、具
核梭杆菌、海尔曼螺杆菌,粪肠球菌、产气肠杆菌、肺炎克雷伯氏菌、 肠炎沙门氏菌、副溶血弧菌、霍乱弧菌、B 族链球菌、小肠耶尔森菌、 痢疾志贺氏菌、伤寒沙门菌、甲副伤寒沙门菌、乙副伤寒沙门菌、丙 副伤寒沙门菌、鼠伤寒沙门菌、弯曲杆菌、艰难芽孢梭状杆菌、产气 荚膜杆菌、蜡样芽孢杆菌、肺炎链球菌、类志贺邻单胞菌、流感嗜血 杆菌、脑膜炎奈瑟菌、结核分枝杆菌)进行了验证,检测结果显示人 粪便样本中常见的具有潜在交叉反应的病原微生物在医学相关水平处 107 copies/mL 时对本试剂盒检测结果无交叉反应,人基因组 DNA 在 100 ng/μL 时对本试剂盒检测结果无交叉反应。此外, 申请人在适用机 型上使用三批试剂盒对常见内源和外源干扰物质(白细胞( 104 个/mL)、 血红蛋白( 1000 mg/dL)、脂肪(500 mg/mL)以及肠道粘液的主要成 分 MUC2 黏蛋白(2000 mg/dL)、肠道疾病常见药物盐酸洛哌丁胺胶 囊、黄连素、痔疮膏、通便灵胶囊、阿莫西林、克拉霉素、左氧氟沙 星、四环素、甲硝唑、奥美拉唑、雷贝拉唑、兰索拉唑、泮托拉唑、 枸橼酸铋钾、阿司匹林、对乙酰氨基酚、铝碳酸镁、乳酸菌素、胃康 灵)进行了验证,结果显示不高于上述浓度时,对本试剂盒的检测结 果没有影响,不会造成假阳性或假阴性。 最低检测限研究中,申请人在适用机型上使用三批试剂盒进行了 研究。最低检测限研究分为 4 部分:( 1 )单一菌株感染下,各耐药型 最低检测限的研究;(2)单一菌株感染下,各耐药型最低检测限的验 证;(3)复合菌株感染下,不同占比的各耐药型的最低检测限研究; (4)复合菌株感染下,不同占比耐药型的最低检测限验证。结果显示:
在单一菌株感染下,当幽门螺杆菌基因组不小于 200 copies/mL 时,阳 性检出率≥95%。在复合菌株感染下,当突变型菌株占总体菌株的比例 大于 40%,且突变菌株浓度高于 200 copies/mL 时,阳性检出率≥95%。 (四)阳性判断值研究 申请人使用该产品对 112 例临床样本进行相关检测,对样本的 Tm 值,采用 ROC 曲线法进行统计分析,初步确定阳性判断值。 申请人使用该产品对 163 例临床样本进行阳性判断值的验证。结 果显示阳性符合率、阴性符合率和总符合率均为 100%。建立的阳性判 断值能准确判断检测结果的阴、阳性。 (五)稳定性研究 申请人对本产品进行了稳定性研究,包括实时稳定性、使用稳定 性、运输稳定性等。研究结果表明:试剂盒在-15℃及以下避光储存, 保存期限为 12 个月。开封后置于-15℃及以下避光储存,可稳定储存 至效期末。避免反复冻融(冻融次数不得超过 5 次)。运输稳定性研 究结果支持说明书声称。 样本稳定性研究:为考察该产品对不同条件下储存不同时间的样 本的检出性能,申请人使用该产品分别对短期储存、长期储存的样本 进行测试,研究结果支持说明书声称。 申请人在南昌大学第一附属医院、南京市第一医院、浙江省中医 院、泰州市人民医院共四家临床机构完成了临床试验。临床试验主要 包括三部分内容:
第一部分,针对试验用体外诊断试剂用于幽门螺杆菌克拉霉素耐 药和左氧氟沙星耐药的辅助诊断用途,采用试验用体外诊断试剂与幽 门螺杆菌体外药敏试验(E-test)进行比较研究。与克拉霉素体外药敏 试验(E-test) 比对研究中共入组 1196 例病例,其中体外药敏试验检 出克拉霉素耐药 566 例,克拉霉素敏感菌株 630 例,研究结果显示, 试验用体 外诊 断试剂 临床 灵敏度是 93.64% ( 95%CI : 91.32% ~ 95.37%),临床特异度是 88.57%(95%CI:85.85%~90.83%)。与左 氧氟沙星体外药敏试验(E-test) 比对研究中共入组 1166 例病例,其 中体外药敏试验检出左氧氟沙星耐药菌株 536 例,左氧氟沙星敏感菌 株 630 例,试验用体外诊断试剂临床灵敏度是 87.13%( 95%CI: 84.03%~89.70%),临床特异度是 90.48%(95%CI:87.93%~92.53%)。 考核试剂与体外药敏试验结果符合率良好。 第二部分,采用试验用体外诊断试剂与 Sanger 测序法进行对比试 验。针对 23S rRNA 基因,共入组病例 1309 例,其中,测序检出 23S rRNA 基因的 3 种常见突变阳性 652 例,突变阴性 657 例,两种方法 的阳性符合率为 97.39%(95%CI:95.86%~98.37%),阴性符合率为 95.59%(95%CI:93.73%~96.91%),总符合率为 96.49%(95%CI: 95.34%~97.36%)。针对 gyrA 基因,共入组样本 1193 例,其中,测 序检出 gyrA 基因的 6 种常见突变阳性 524 例,突变阴性 669 例,两种 方法的阳性符合率为 96.37%(95%CI:94.41%~97.67%),阴性符合 率为 93.42%(95%CI:91.29%~95.06%),总符合率为 94.72%(95%CI: 93.30%~95.85%)。试验还对所有突变位点进行了单独统计,各位点
第三部分,采用试验用体外诊断试剂与已上市的幽门螺杆菌核酸 检测试剂盒(PCR 荧光探针法)进行对比试验,共入组样本 497 例, 其中对比试剂检出阳性 303 例,阴性 194 例,两种方法的阳性符合率 为 97.36%(95%CI:94.88%~98.66%),阴性符合率为 96.91%(95%CI: 93.42%~98.58%), 总符合率为 97.18%(95%CI:95.33%~98.31%)。 综上所述,临床试验结果显示本产品的临床性能满足技术审评要 求。 根据申请人提供的申报资料,经综合评价,在目前认知水平上, 认为该产品的上市为适用人群带来的受益大于风险。但为保证用械安 全,基于对主要剩余风险的规避, 需要在说明书中提示以下信息: 1.本试剂盒的检测结果应结合患者临床诊断结果等情况进行综合 分析,不作为患者临床诊治或管理的唯一依据。 2.本试剂盒仅针对幽门螺杆菌克拉霉素和左氧氟沙星已知耐药基 因(23SrRNA 和 gyrA)的高频突变类型进行了验证。本品不能用于检 测由其他耐药机制或其他耐药基因及基因区域突变引起的耐药。 3.本产品结果只对样本是否存在突变进行判断,不具体区分突变 类型。 4.当样本中幽门螺杆菌含量低于试剂盒检测下限时,可能导致样 本检测结果(ROX 或 FAM 通道)不呈现熔解峰, 因而无法进行耐药 判断。
5.当样本中幽门螺杆菌耐药菌株比例低于试剂盒检测下限时,可 能导致样本熔解峰与野生型熔解峰一致,样本判定为药物敏感,造成 假阴性结果。
本申报项目为境内第三类体外诊断试剂产品注册。申请人的注册 申报资料符合现行要求,依据《医疗器械监督管理条例》(国务院令 第 739 号)、《体外诊断试剂注册与备案管理办法》(国家市场监督 管理总局令第 48 号)等相关医疗器械法规与配套规章,经系统评价后, 建议准予注册。
2024 年 11 月 7 日
附件:产品说明书
幽门螺杆菌23S rRNA/gyrA基因突变检测试剂盒 (荧光PCR熔解曲线法)说明书 【产品名称】
通用名称:幽门螺杆菌23S rRNA/gyrA基因突变检测试剂盒(荧光PCR熔解曲线法)
【包装规格】 48测试/盒 【预期用途】
本产品用于定性检测幽门螺杆菌阳性患者正常粪便样本中幽门螺杆菌 23S rRNA 基因 A2142G、A2142C、A2143G 突变和 gyrA 基因 A260T、C261A、T261G、G271A、G271T、A272G 突变。结果只对样本是否存在突变进行判断,不具体区分突变位点。 本产品通过检测幽门螺杆菌 23S rRNA 基因 2142、2143 位点和 gyrA 基因 87、91 号密码子 的突变,为临床医生评估个体中幽门螺杆菌的耐药特性提供参考。具体检测的突变位点与耐药 类型的关系详见表 1。 幽门螺杆菌感染是胃炎最主要的致病因素,也是诱发胃癌的危险因素。幽门螺杆菌对抗生 素产生耐药已经成为其根除率下降的最主要原因。目前已明确的幽门螺杆菌耐药机制包括:1) 克拉霉素耐药:幽门螺杆菌 23S rRNA 基因编码肽酰转移酶区发生点突变,导致核糖体构象发生 改变、抑制克拉霉素和幽门螺杆菌核糖体的结合,从而产生菌体耐药性;2)左氧氟沙星耐药: 幽门螺杆菌编码 DNA 螺旋酶亚单位的 gyrA 基因的喹诺酮类抗生素耐药决定区发生突变,导致 左氧氟沙星对 DNA 螺旋酶调控 DNA 拓扑结构功能的抑制作用减弱或丧失,从而产生菌体耐药 性。 本产品检测结果仅供临床参考,不应作为治疗药物调整的唯一依据,临床医生应结合患者 病情及其他检测指标对患者治疗进行综合判断。 表1 可检测的幽门螺杆菌23S rRNA和gyrA基因突变类型
【检验原理】
本产品采用荧光 PCR 熔解曲线法,其基本原理为:1)根据耐药基因突变位置上下游序列 设计 PCR 扩增引物,并根据耐药基因突变设计荧光探针;2)通过不对称 PCR 扩增,生成与荧 光探针杂交的单链寡核苷酸序列;3)PCR 扩增完成后,在熔解曲线分析过程中实时检测反应体 系荧光信号强度的变化,从而绘制反应体系的熔解曲线,并可确定该熔解曲线的熔点(Tm 值), 由此推断该序列的突变信息。 【主要组成成分】
备注: 1. 不同批次试剂盒的组分不可混用。 2. 需要但未提供:实时荧光定量 PCR 仪、涡旋震荡仪、生物安全柜、移液器、移液器吸头、离心机、PCR 反应管、1.5mL 离心管、一次性使用粪便采集保存管(货号:CWY041L,型号 I,苏泰械备 20190177 号)、 核酸提取或纯化试剂(货号:CWY095SE32 ,型号二,苏泰械备 20200970 号)、ddH2O。
【储存条件及有效期】
试剂盒在-15℃及以下避光储存,保存期限为 12 个月。
开封后置于-15℃及以下避光储存,可稳定储存至效期末。避免反复冻融(冻融次数不得超 过 5 次)。 试剂盒采用泡沫箱加干冰运输,在途时间不超过 7 天,开箱后温度不超过 10℃。
生产日期及有效期至(或失效日期)见标签。 【适用仪器】 ABI 7500 实时荧光定量 PCR 仪。 【样本要求】 适用样本类型:人粪便样本。根据布里斯托大便分类法一共有七种类别。第一类:一颗颗硬 球(很难通过)。第二类:香肠状,但表面凹凸。第三类:香肠状,但表面有裂痕。第四类:像香 肠或蛇一样,且表面很光滑。第五类:断边光滑的柔软块状(容易通过)。第六类:粗边蓬松块, 糊状大便。第七类:水状,无固体块(完全液体)。本产品适用的样本为第三、四、五类粪便样 本。 样本采集:使用江苏康为世纪生物科技股份有限公司生产的 50mL 一次性使用粪便采集保 存管(苏泰械备 20190177 号)进行粪便样本的采集。采集粪便时先将粪便排至采样垫中间区域 或无其余粪便污染的区域,然后立即取样;打开一次性使用粪便采集保存管,用采样器取大拇 指第一关节大小的粪便(约 5g),此时液面到达采样管红线处;旋紧管盖,摇晃约 30 秒混匀, 完成粪便采集。样本的采样量过大或过小可能导致样本检测不准确。 样本保存及运输:粪便样本采集后应立即置于粪便样本采集保存管中,于 2~37℃进行保存, 不超过 3 个月。样本运输采用常温运输方式,避免保存管破损。 样本 DNA 的保存:提取后的样本 DNA 建议在-15℃及以下保存,时间不超过 3 个月。 【检验方法】 1. 试剂准备(试剂准备区)
1.1. 提前将试剂取出并平衡至室温,各组分充分融解,震荡混匀后快速离心10秒。
1.2. 确定反应数N:根据检测样本数计算所需反应数N,即反应数N=n+2(n为待检样本数,2 为野生型对照和阴性对照)。按表2进行反应体系配制。 表2 反应体系配制
1.3. 反应体系分装:准备相应数量的PCR管/板,将上述混合反应液震荡30s,快速离心5s, 按30μL/管分装至PCR管/板中。 1.4. 将分装好的PCR管/板转移至样本准备区备用。
2. 样本准备(样本准备区)
2.1. 提取前准备:取200μL Hp-阴性对照(MC)加入100μL ddH2O、取200μL Hp-野生型对照(MC) 加入100μL ddH2O中制备成待提取的对照样本备用。 2.2. 核酸提取:取粪便样本保存管中的待测样本,采用江苏康为世纪生物科技股份有限公司 的核酸提取或纯化试剂(苏泰械备20200970号)对待测样本和待提取的对照样本进行核 酸提取。提取步骤如下: 2.2.1充分摇晃混匀含粪便样本的粪便样本采集保存管。将粪便样本采集保存管以5000rpm 离心2分钟以沉淀粪便颗粒。
2.2.2将96孔预装板从试剂盒中取出放入水平离心机300 g离心10秒钟。
2.2.3将深孔板从离心机中取出,小心去除热封膜,期间防止深孔板震动。
2.2.4向深孔板的1、7列加入300μL离心后的样本上清液,随后加入20μL蛋白酶K溶液和4μL 核糖核酸酶A溶液。
2.2.5将加入样本的深孔板放入仪器中,之后磁棒套固定在磁棒套架上。
2.2.6运行提取程序。
2.2.7待程序暂停后,将深孔板从仪器中取出,向1 、7列加入200μL异丙醇。
2.2.8将深孔板放回仪器中,继续运行程序。待程序运行结束后,取出磁套和深孔板。
2.2.9将深孔板6 、12列中的洗脱产物转移至1.5 mL离心管中低温保存。
2.3. 加样:将20μL提取完毕的待测样本和对照样本核酸分别转移至已分装反应体系的PCR管 /板中,总反应体积为50μL。3000rpm,离心1min,排除管底气泡,管盖和管壁上无液体 残留。 2.4. 将PCR管/板转移到核酸扩增区进行上机检测。
3. PCR扩增(核酸扩增区)
3.1. 取样本准备区准备好的 PCR 反应管/板,放置在仪器样品槽相应位置。并记录放置顺序。 3.2. 打开参数窗口设置循环条件,反应程序如表3所示: 表3 反应程序
3.3. 检测设置:检测通道同时设置ROX通道、FAM通道和Cy5通道。ROX通道指示幽门螺杆 菌23S rRNA基因的有无突变;FAM通道指示幽门螺杆菌gyrA基因的有无突变;Cy5通道 指示内标基因的扩增;对于ABI 7500,则运行程序中“Quencher Dye ”和“Passive Reference ”均设置为None。按照样本对应顺序设置Hp-野生型对照(MC) 、Hp-阴性对照 (MC)和样本。试验运行完成在结果分析时需要单独勾选单个荧光进行熔解峰的分析。 【阳性判断值】
当野生型对照品FAM荧光的Tm值在60℃~68℃之间,ROX荧光的Tm值在60℃~68℃之间, Cy5荧光的Tm值在62℃~70℃之间;阴性对照品FAM和ROX均无熔解峰,Cy5荧光的Tm值在62℃ ~70℃之间。可对样本按照下表所示进行判读: 表4 Tm值与结果判断关系表
对各种分型的幽门螺杆菌阳性粪便样本和阴性粪便样本进行检测后,分析所有幽门螺杆菌 阳性的样本,确定荧光通道的Tm值范围。然后用ROC曲线确定野生型和突变型的判读cut-off值。 再用幽门螺杆菌阳性粪便样本和幽门螺杆菌阴性粪便样本对cut-off值进行验证,确定幽门螺 杆菌的判读cut-off值如上表所示。 【检测结果的解释】
1. 质量控制
有效检测需要同时满足以下条件:
1)野生型对照:ROX、FAM、Cy5通道呈现野生型熔解峰和内标熔解峰,且FAM荧光的Tm 值在60℃~68℃之间,ROX荧光的Tm值在60℃~68℃之间,Cy5荧光的Tm值在62℃~70℃之间;
2)阴性对照:Cy5通道呈现内标熔解峰,且Tm值在62℃~70℃之间,FAM和ROX通道不呈 现熔解峰;
3)样本:ROX 、FAM 、Cy5至少任意通道呈现熔解峰,且Tm值满足表4的温度范围。
2. 样本检测结果的判断
当荧光定量PCR仪运行结束后,用其配套软件对本次试验的结果进行熔解峰分析,一般情 况下有效熔解峰的纵坐标值需要大于0。
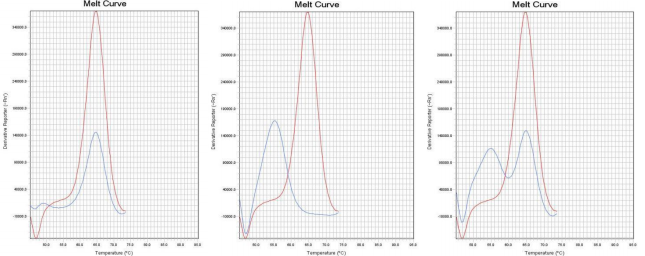
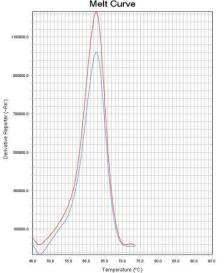
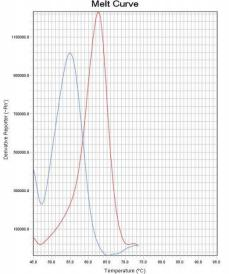
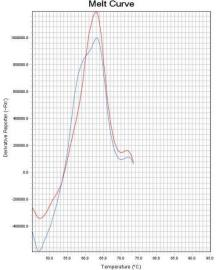
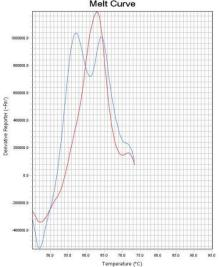
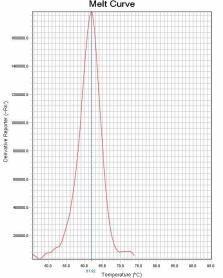
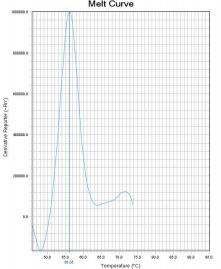
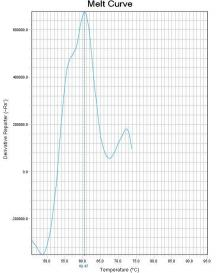
通过比较待测样本和野生型对照在ROX和FAM通道熔解峰的Tm差异来判断样本是否存在 耐药突变。 若样本PCR反应ROX通道的熔解峰Tm值在“野生型对照Tm值-2℃ ”~ “野生型对照Tm值 +2℃ ”范围内,则23S rRNA 为野生 型 峰 ;若样本PCR 反应ROX 通道的熔解峰Tm 值在 “51℃ ”~“野生型对照Tm值-2℃ ”范围内,则23S rRNA为突变型峰。 若样本PCR反应FAM通道的熔解峰Tm值在“野生型对照Tm值-2℃ ”~“野生型对照Tm值 +4℃ ”范围内时,则gyrA为野生型峰;若样本PCR反应FAM通道的熔解峰Tm值在“50℃ ”~“野 生型对照Tm值-2℃ ”范围内,则gyrA为突变型峰。 若样本PCR反应Cy5通道的熔解峰Tm值在“野生型对照Tm值-2℃ ”~ “野生型对照Tm值 +2℃ ”范围内时,则认为内标有扩增。Tm值与结果判断关系见表4。 如果样本的ROX/FAM通道只有野生型熔解峰(图1、图4),则该样本为23S rRNA野生型/gyrA 野生型,即:克拉霉素敏感/左氧氟沙星敏感;如果样本的ROX/FAM通道只有突变型熔解峰(图 2 、图5),则该样本为23S rRNA突变型/gyrA突变型,即:克拉霉素耐药/左氧氟沙星耐药;如 果样本的ROX/FAM通道既有野生型熔解峰又有突变型熔解峰(图3、图7),则该样本为23S rRNA 混合型/gyrA混合型,即:克拉霉素耐药/左氧氟沙星耐药;当突变型熔解峰与野生型熔解峰的Tm 相差较小时,混合型样本的突变型和野生型熔解峰会“融合 ”,表现为一个较野生型熔解峰明 显增宽、并呈现“肩状 ”形态的融合峰(图6),则该样本为23S rRNA混合型/gyrA混合型,即: 克拉霉素耐药/左氧氟沙星耐药。 融合型峰图判读可以采用如下办法:判读人员可以在熔解曲线峰顶对应的Tm处做中垂线(荧 光PCR仪分析程序能够自动生成该垂线),观察中垂线左右两侧是否对称。纯合野生型样本(图 8)或纯合突变型样本(图9)左右两侧是完全对称的。如果样本左侧明显大于右侧,并且凸起 处峰高纵坐标大于0,则可判读为“野生型含量比例较高的融合峰”(图10),即:克拉霉素耐 药/左氧氟沙星耐药。如果样本右侧明显大于左侧,并且凸起处峰高纵坐标大于0,则可判读为“突 变型含量比例较高的融合峰”(图11),即:克拉霉素耐药/左氧氟沙星耐药。
图1 23S rRNA野生型 图2 23S rRNA突变型 图323S rRNA混合型
图4 gyrA野生型 图5 gyrA突变型
图6 gyrA混合型 图7 gyrA混合型
图8 gyrA野生型峰 图9 gyrA突变型峰
图10野生型含量比例较高的融合峰 图11突变型含量比例较高的融合峰
【检验方法的局限性】
1. 本试剂盒的检测结果应结合患者临床诊断结果等情况进行综合分析,不作为患者临床诊治或 管理的唯一依据。
2. 本试剂盒仅针对幽门螺杆菌克拉霉素和左氧氟沙星已知耐药基因(23S rRNA和gyrA)的高频 突变类型进行了验证。本品不能用于检测由其他耐药机制或其他耐药基因及基因区域突变引 起的耐药。
3. 本产品结果只对样本是否存在突变进行判断,不具体区分突变类型。
4. 当样本中幽门螺杆菌含量低于试剂盒检测下限时,可能导致样本检测结果(ROX或FAM通道) 不呈现熔解峰,因而无法进行耐药判断。
5. 当样本中幽门螺杆菌耐药菌株比例低于试剂盒检测下限时,可能导致样本熔解峰与野生型熔 解峰一致,样本判定为药物敏感,造成假阴性结果。
【产品性能指标】
1. 准确度 检测若干份突变型及野生型的临床样本,阳性符合率和阴性符合率均为 100%。 2. 精密度 检测中阳性,临界阳性以及阴性样本,从样本提取开始进行为期 20 天的连续检测,每天由 2 人用不同的仪器完成 2 次完整检测,批内批间精密度、日内日间精密度、人间精密度、室间精 密度 CV(%)值≤5%。 3. 最低检测限 试剂盒最低检测限为幽门螺杆菌基因组 200copies/mL。 在 500copies/mL 幽门螺杆菌基因组 DNA 背景下,试剂盒突变检测灵敏度为 40%。 4. 分析特异性 4.1 交叉反应 试剂盒对浓度为 107copies/mL 的空肠弯曲菌、萎缩芽孢杆菌、埃希氏大肠杆菌、阴沟肠杆 菌、普通变形杆菌、白色念珠菌、屎肠球菌、铜绿假单胞菌、金黄色葡萄球菌、乳酸乳球菌、 短双歧杆菌、脆弱拟杆菌、具核梭杆菌和海尔曼螺杆菌、粪肠球菌、产气肠杆菌、肺炎克雷伯 氏菌、肠炎沙门氏菌、副溶血弧菌、霍乱弧菌、B 族链球菌、小肠耶尔森菌、痢疾志贺氏菌、 伤寒沙门菌、甲副伤寒沙门菌、乙副伤寒沙门菌、丙副伤寒沙门菌、鼠伤寒沙门菌、弯曲杆菌、 艰难芽孢梭状杆菌、产气荚膜杆菌菌、蜡样芽孢杆菌、肺炎链球菌、类志贺邻单胞菌、流感嗜 血杆菌、脑膜炎奈瑟菌、结核分枝杆菌,以及人源 293T 细胞系(100ng/μL)均无交叉反应。 经研究发现 23S rRNA 基因的 C2134G 突变可能引起克拉霉素耐药的误判。gyrA 基因 C255A 、C255T 、G264A 、G264T 、G264C 突变可能引起左氧氟沙星耐药的误判。 4.2 干扰反应 白细胞(104 个/mL)、血红蛋白(1000mg/dL)、脂肪(500mg/mL)以及肠道粘液的主要 成分 MUC2 黏蛋白(2000mg/dL)、盐酸洛哌丁胺胶囊(0.16mg/g)、黄连素(3.6mg/g)、痔
疮膏(10mg/g)和通便灵胶囊(15mg/g)、阿莫西林(2.5mg/mL)、克拉霉素(2.5mg/mL)、 左氧氟沙星(5.0mg/mL)、四环素(5.0 mg/L)、甲硝唑(40.0 mg/L)、奥美拉唑(0.4mg/L)、 雷贝拉唑(0.802 mg/L)、兰索拉唑(1.15 mg/L)、泮托拉唑(3.81 mg/L)、枸橼酸铋钾(67.85mg/L)、 阿司匹林(300.0 mg/L)、对乙酰氨基酚(13.824 mg/L)、铝碳酸镁(1500.0 mg/L)、乳酸菌 素(3600.0 mg/L)、胃康灵(100.0 mg/L)在上述浓度时对本试剂盒的检测没有干扰。 5. 临床性能 在 4 家临床机构完成 1705 例临床样本检测,与一代测序法进行对比,23S rRNA 基因的阳 性符合率为 97.39%,阴性符合率为 95.59%,总符合率 96.49%;gyrA 基因的阳性符合率 96.37%, 阴性符合率为 93.42%,总符合率为 94.72%。 与体外药敏试验进行对比,克拉霉素耐药的临床灵敏度是 93.64%,临床特异度是 88.57%; 左氧氟沙星耐药的临床灵敏度是 87.13%,临床特异度是 90.48%。 【注意事项】
1. 本产品仅供体外诊断使用,使用后废弃物按医疗废物处理。
2. 实验室管理应严格按照国家有关分子生物学实验室、临床基因扩增实验室的管理规范执行。 实验各阶段应在不同试验区域进行,包括试剂准备区、样本处理区及检测区。每个区的仪器 设备不得交叉使用;各区人员流动及空气流向应有严格要求,最大限度避免交叉污染。操作 人员应具有PCR经验及受过相关培训。
3. 使用本试剂盒检测,请按传染病实验室检查规程操作。
4. 每次试验需要检测野生型对照、阴性对照。
5. 请必须使用本说明书中配套的一次性粪便样本采集保存管和核酸提取或纯化试剂盒,不得使 用其他产品。
6. 试剂盒各组分使用前请充分融化并震荡混匀,试剂需离心数秒后使用。加样时应使样品完全 加入反应液中,加样后应尽快盖紧管盖或密封封口膜,并适时离心。反应液分装时尽量避免 产生气泡,上机前注意检查各反应管是否盖紧/封口膜无翘起。 7. 扩增结束后取出反应管/板,密封在专用塑料袋内,按照医疗废物处理。扩增结束后不要随意 松开管盖或撕开封口膜,避免气溶胶污染。
8. 操作过程中用到的生物安全柜、移液器、离心机、实时荧光定量PCR仪等仪器设备应经常用
10%次氯酸或70%乙醇及紫外灯交替处理。 实验中废弃的吸头应弃于含10%次氯酸的废液缸 中,以防止污染。 【参考文献】 [1]Qiuying H,Zanzan L,Yiqun L , et al. Multiplex Fluorescence Melting Curve Analysis for Mutation Detection with Dual-Labeled, Self-Quenched Probes. PLoS One . 2011 Apr 28;6(4):e19206.
[2] Rimbara E,Noguchi N,Kawai T,et al. Fluoroquinolone resistance in Helicobacter pylori :role of mutations at position 87 and 9 l of GyrA on the level of resistance and jdenti6cation of a resistance conferring mutation in GyrB[J] Helicobacter ,2012 ,17(1) :3642 . [3] Schabereiter-Gurtner C, HirschlAM, Dragosics B,et al. Novel real-time PCR assay for detection of Helicobacter pylori infection and simultaneous clarithromycin susceptibility testing of stool and biopsy specimens. J Clin Microbiol. 2004 Oct;42(10):4512-18. [4] K S Elenitoba-Johnson, S D Bohling, C T Wittwer,et al. Multiplex PCR by multicolor fluorimetry and fluorescence melting curve analysis. Nat Med . 2001 Feb;7(2):249-53.
[5] Woo HY, Park DI, Park H, et al. Dual-priming oligonucleotide-based multiplex PCR for the detection of Helicobacter pylori and determination of clarithromycin resistance with gastric biopsy specimens. Helicobacter. 2009 Feb;14(1):22-8. [6]Chen J, Ye L, Jin L, et al. Application of next-generation sequencing to characterize novel mutations in clarithromycin-susceptible Helicobacter pylori strains with A2143G of 23S rRNA gene. Ann. Clin. Microbiol. Antimicrob. 17:10.doi:10.1186/s12941-018-0259-8 【基本信息】 注册人/生产企业名称:江苏健为诊断科技有限公司 住所:泰州市药城大道五期厂房 G131 号楼 2-3 层 邮政编码: 联系方式:
售后服务单位名称: 联系方式: 生产地址:泰州市药城大道五期厂房 G131 号楼 3 层
生产许可证编号或者生产备案编号:
【医疗器械注册证编号/产品技术要求编号】 【说明书批准日期/生效日期及修改日期】 |