受理号:CSZ2100259
体外诊断试剂产品注册技术审评报告
产品中文名称:人 PCA3 、PSA 基因检测试剂盒(荧光 PCR 法)
产品管理类别:第三类
申 请 人 名称: 江苏为真生物医药技术股份有限公司
国家药品监督管理局 医疗器械技术审评中心
目 录
基本信息 3
一、申请人名称 3
二、申请人住所 3
三、生产地址 3
技术审评概述 4
一、产品概述 4
二、临床前研究概述 5
三、临床评价概述 10
四、产品受益风险判定 11
综合评价意见 12
基本信息
一、申请人名称
江苏为真生物医药技术股份有限公司
二、申请人住所
苏州市工业园区星湖街 218 号生物纳米园 C4 楼 201 、301 室
三、生产地址
苏州工业园区金鸡湖大道 99 号纳米城西北区 16 栋2 层,苏州市 工业园区星湖街 218 号生物纳米园 C4 楼 201 、301 室
技术审评概述
一、产品概述
( 一)产品主要组成成分
试剂盒由 2 部分组成,分别为人 PCA3/PSA 基因 mRNA 提取试 剂、人 PCA3/PSA 基因检测试剂。(具体内容详见产品说明书)
(二)产品预期用途
本产品用于体外检测总 PSA 在 4~10 ng/mL(灰度区)的疑似前列 腺癌患者尿液样本中 PCA3 基因及 PSA 基因的表达量,通过计算 PCA3 基因与 PSA 基因表达量的比值,作为是否需要穿刺活检的辅助诊断指 标。
本产品不能单独决定是否需要穿刺活检,临床医生应结合患者的 临床表现和其他实验室检查等指标进行综合分析,做出诊断。本产品 不得单独作为疾病管理决定的依据。
近年来发现的前列腺癌新的标记物 PCA3(Prostate cancer antigen 3 ),在前列腺癌中高表达,但在良性前列腺组织、其他类型的正常组 织或肿瘤中不表达或极低表达。PSA 为前列腺特异抗原,PSA 具有组 织特异性,只存在于人前列腺腺泡及导管上皮细胞胞浆中,不表达于 其他细胞,但它并无肿瘤特异性。PCA3 得分不会因前列腺体积大小而 改变,而血清 f/tPSA 却受前列腺增大因素的影响,在前列腺炎、前列 腺增生、尿道感染等非癌性疾病中也会升高。
(三)产品包装规格
12 测试/盒。
(四)产品检验原理
本试剂盒基于磁珠特异性捕获和一步法 PCR 技术检测原理,定性 检测行直肠指检后尿液中 PCA3 、PSA 基因。
尿液中 PCA3、PSA mRNA 的提取采用磁珠特异性捕获方法。Oligo d(T)磁珠特异性结合含 polyA 的捕获探针,同时针对 PCA3 、PSA mRNA 基因序列设计的捕获探针与互补的靶序列特异性结合,从而对 靶向基因进行富集提取,避免非靶标核酸的干扰。其原理示意图如下:
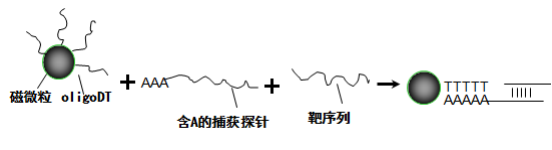
提取后的 RNA 采用一步法进行荧光 PCR 检测,实现 cDNA 合成 与 PCR 反应在同反应体系中进行。同时 PCR 反应体系中含有防止 PCR 产物污染的尿嘧啶-DNA 糖基化酶(UDG),能有效地水解单链或双链 DNA 上的尿嘧啶,从而避免了PCR 模板污染导致的假阳性。
检测样本与校准品、阳性质控品、阴性质控品一起进行提取和扩 增,通过校准曲线获得 PCA3 和 PSA 基因的浓度,进而计算出 PCA3 基因与 PSA 基因的比值得分(Score 值)。
二、临床前研究概述
(一)主要原材料
1.主要原材料的选择
本产品的主要原材料包括:磁珠、捕获探针、dNTP、逆转录酶、 尿嘧啶-DNA 糖基化酶、RNase 抑制剂、Taq 酶、引物和探针等。这些 原材料均是通过外购的方式获得。其中引物、探针的序列由申请人自 行设计,由合成公司制备。申请人对主要原材料进行了供应商的选择, 通过功能性试验筛选出合格供应商,制定了主要原材料的技术要求和 质量标准并经检验合格。
2.企业参考品和质控品的设置情况
本产品企业参考品包括提取参考品、准确度参考品、阳性符合率 参考品,特异性参考品、PCA3 交叉特异性参考品、PSA 交叉特异性参 考品、线性参考品、定量限参考品和精密度参考品。
提取参考品包括 PCA3 和 PSA 两个基因的两个浓度水平的样本; 准确度参考品包括 PCA3 和 PSA 两个基因的两个浓度水平样本;阳性 符合率参考品 10 个,为不同 Score 值水平的前列腺癌尿液样本;特异 性参考品 10 个,为非前列腺癌患者尿液样本;PCA3 交叉特异性参考 品,为包含 PSA 基因样本;PSA 交叉特异性参考品,为包含 PCA3 基 因样本;线性参考品包括 PCA3 和 PSA 两个基因的 5 个不同浓度梯度 的样本;定量限参考品 2 种,分别为 PCA3 和 PSA 基因的定量限浓度 水平的样本;精密度参考品包括 PCA3 和 PSA 2 个基因的2 个不同浓 度的样本。
本试剂盒设置了阳性质控品和阴性质控品各两支。质控品由分别 包含不同浓度体外转录 PCA3 RNA 和体外转录 PSA RNA 的样本组成,
可用于检测过程中的质量控制。
(二)生产工艺及反应体系研究
申请人对试剂盒反应体系的研究包括:捕获液中 HEPES 浓度的确 定、捕获液中 LiCl 浓度的确定、磁珠用量的确定、捕获探针用量的确 定、引物探针浓度的确定、DNA 聚合酶用量的确定、逆转录酶浓度的 确定、UDG 酶浓度的确定、镁离子浓度的确定、dNTP 浓度的确定、 PCR 反应体积的确定、PCR 模板体积的确定。对反应条件包括 UDG 酶作用温度和时间、逆转录温度时间、PCR 反应退火温度与时间、反 应循环数等。通过功能性实验,最终确定了最佳反应体系。
申请人根据试剂盒中试剂及组件的主要生产工艺的研究结果,确 定了最佳的生产工艺。
(三)分析性能评估
本试剂盒的分析性能评估内容主要包括:核酸提取性能、准确性、 精密度、检出限、分析特异性(交叉反应、干扰试验)、线性等。申请 人提交了有效运行的质量管理体系下生产的三批产品在适用机型上的 性能评估资料。
在核酸提取性能研究中,申请人采用试剂盒包含的提取试剂,对 5 例高值前列腺癌样本进行提取,评价提取浓度、纯度等性能,结果表 明该核酸提取试剂的提取性能符合研制设计要求。
准确度的研究中,申请人采用三批成品试剂盒,对准确度参考品、 阳性符合率参考品进行检测,结果符合接受标准。同时选择了若干例 临床确诊为前列腺癌或非前列腺癌的临床尿液样本,与数字PCR 方法
同步进行真实临床尿液样本检测。测试结果:本检测试剂检测结果与 数字 PCR 方法检测结果一致性良好,浓度检测结果符合接受标准。
精密度研究中,申请人使用三批试剂,分别对中阳性、临界阳性 和阴性 3 个水平的样本,进行了 20 天的多次检测,对批内/间、操作 者间、日内/间、室内精密度和室间精密度等进行了评价。结果表明: 精密度良好, PCA3 基因和 PSA 基因检测浓度对数值的变异系数 ( CV,%)≤5%;PCA3 Score 值的变异系数( CV,%)≤ 20%。
检出限的研究中,申请人使用三批试剂,检测两个靶基因不同浓 度梯度的样本,将≥95%阳性检出率的浓度水平作为确定的检出限, 并进行检出限验证。最终确定 PCA3 检出限不高于 1000 copies/mL; PSA 检测限不高于 6000 copies/mL。
分析特异性研究包含交叉反应和干扰研究, 申请人对 PCA3 与 PSA 基因之间的交叉、与非靶标的交叉以及检测样本相关常见微生物 (白色念珠菌、大肠杆菌、肺炎克雷伯菌、奇异变形杆菌、假单胞菌、 金黄色葡萄球菌) 的交叉反应进行研究,结果显示:检测试剂与上述 病原体无交叉。申请人对尿液常见的外源及内源干扰物质进行研究, 结果显示: 白蛋白(≤60 g/L)、未结合胆红素(≤342 μmol/L)、胆 固醇(≤13 mmol/L)、葡萄糖(≤55 mmol/L)、血红蛋白(≤2 g/L)、 免疫球蛋白 G (≤ 32 mg/L)、甘油三酸脂(≤ 37 mmol/L)、尿酸(≤ 1.4 mmol/L)、红细胞(≤ 5.10 × 107 cell/L)、白细胞(≤ 7.60 × 107 cell/L)、 对乙酰氨基酚(≤ 1.324 mmol/L)、乙酰水杨酸(≤3.62 mmol/L)、阿 呋唑嗪(≤30 mg/L)、别嘌呤醇(≤ 0.294 μmol/L)、氨氯地平(≤ 0.245
μmol/L)、阿替洛尔(≤37.6 μmol/L)、阿托伐他汀(≤25 mg/L)、 环丙沙星(≤ 30.2 μmol/L)、苯海拉明(≤19.6 pmol/L)、度他雄胺(≤ 1.5 mg/L)、非那雄胺(≤ 15 mg/L)、氟西汀(≤ 11.2 μmol/L)、氟他 胺(≤2.25 g/L)、呋喃苯胺酸(≤0.181 mmol/L)、布洛芬(≤2.425 mmol/L)、左氧氟沙星(≤ 48.6 μmol/L)、赖诺普利(≤0.74 pmol/L)、 盐酸二甲双胍(≤0.31 mmol/L)、硒(≤ 1 mg/L)、西地那非(≤ 12.9 nmol/L)、坦索罗辛(≤ 1.2 μg/L)、特拉唑嗪(≤7.8 μmol/L)、钙(≤ 5 mmol/L)、多沙唑嗪(≤ 1.3 3pmol/L)、强力霉素(≤ 1.35 pmol/L)、 呋磺胺(≤0.181 mmol/L)、锯棕榈(≤11.25 g/L)、柳氮磺胺吡啶(≤ 0.754 mmol/L)),未对检测结果产生干扰影响。
在线性研究中,申请人采用三批成品试剂盒,对包含高浓度靶基 因的样本进行梯度稀释后重复检测,确定 PCA3 样本线性范围为 1.25 × 103 copies/mL~1.25 × 107 copies/mL 、PSA 样本线性范围为 6.25 × 103 copies/mL~6.25 × 107 copies/mL。
(四)阳性判断值研究
申请人采用总PSA 在 4~10 ng/mL(灰度区)的疑似前列腺癌患者 的尿液样本 212 例。使用申报产品对临床样本进行检测并计算 Score 值,与临床诊断结果进行对比,经 ROC 曲线分析,根据约登指数最大 原则,确定试剂盒的阳性判断值为:Score 值>40.1518 时检测结果为阳 性,Score 值≤40.1518 时检测结果为阴性。
(五)稳定性研究
申请人对本产品进行了稳定性研究,包括实时稳定性、使用稳定
性等。研究结果表明:试剂盒组分 1 于 2~8℃保存,组分 2 于-20℃± 3℃中保存,其中 2 ×PCA3 反应液和 2 ×PSA 反应液于-20℃±3℃避 光保存。试剂盒有效期为 12 个月。试剂盒的开封稳定性研究结果支持 说明书声称。
样本稳定性研究:为考察该产品对不同条件下储存不同时间的样 本的检出性能,申请人使用该产品分别对短期储存、长期储存的样本 进行测试,研究结果支持说明书声称。
三、临床评价概述
申请人在上海市第十人民医院、复旦大学附属华东医院、昆山市 第一人民医院和浙江省人民医院共四家临床试验机构开展临床试验。 采用试验体外诊断试剂与临床参考标准进行比较研究,同时进行临床 常规使用的游离 PSA 与总 PSA 比值(fPSA/tPSA)与临床参考标准比 较研究,并进一步比较试验体外诊断试剂与 fPSA/tPSA 的临床性能, 从而确认试验体外诊断试剂的预期用途,其中,临床参考标准采用穿 刺活检病理结果。
临床试验共前瞻性纳入 556 例疑似前列腺癌患者,主要包括总 PSA(tPSA)在 4~10ng/mL 的疑似前列腺癌患者。试验体外诊断试剂 检测样本类型为尿液样本,PSA 指标检测样本类型为血清。
临床试验结果显示,针对 tPSA 在 4~10ng/mL 的疑似前列腺癌患 者,试验体外诊断试剂与临床参考标准对比的临床灵敏度为 79.1% (95%CI:69.7%,86.2%),临床特异度为 83.1%(95%CI:76.1% , 88.4%),总符合率为 81.6%(95%CI:76.1%,86%),阳性预测值为 75%
(95%CI:65.5%,82.6%), 阴性预测值为 86.1%(95%CI:79.4% , 90.9% ); fPSA/tPSA 与临床参考标准对比的临床灵敏度为 64.8% (95%CI:54.6%,73.9%),临床特异度为 76.1%(95%CI:68.4% , 82.3%),总符合率为 71.7%(95%CI:65.6% ,77.1%),阳性预测值为 63.4%(95%CI:53.3%,72.5%),阴性预测值为 77.1%(95%CI:69.5% , 83.3%)。上述结果显示,针对 PSA 在 4~10ng/mL 的疑似前列腺癌患 者,试验体外诊断试剂具有较好的临床性能。
综上,试验体外诊断试剂的临床性能满足技术审评要求。
四、产品受益风险判定
根据申请人提供的申报资料,经综合评价,在目前认知水平上, 认为该产品的上市为适用人群带来的受益大于风险。但为保证用械安 全,基于对主要剩余风险的规避, 需要在说明书中提示以下信息:
1.预期用途
本产品用于体外检测总 PSA 在 4~10 ng/mL(灰度区)的疑似前列 腺癌患者尿液样本中 PCA3 基因及 PSA 基因的表达量,通过计算 PCA3 基因与 PSA 基因表达量的比值,作为是否需要穿刺活检的辅助诊断指 标。
本产品不能单独决定是否需要穿刺活检,临床医生应结合患者的 临床表现和其他实验室检查等指标进行综合分析,做出诊断。本产品 不得单独作为疾病管理决定的依据。
2.警示及注意事项:该试剂盒说明书中明确了该试剂盒检查方法 的局限性及使用中的注意事项。
综合评价意见
本申报项目为境内第三类体外诊断试剂产品注册。依据《医疗器 械监督管理条例》(国务院令第 739 号)、《体外诊断试剂注册与备案管 理办法》(国家市场监督管理总局令第 48 号)等相关医疗器械法规与 配套规章,经对申请人提交的注册申报资料进行系统评价, 申报产品 符合安全性、有效性的要求,符合现有认知水平,建议准予注册。
2025 年 5 月 20 日
附件:产品说明书
人 PCA3 、PSA 基因检测试剂盒(荧光 PCR 法) 使用说明书
【产品名称】人 PCA3 、PSA 基因检测试剂盒(荧光 PCR 法) 【包装规格】12 测试/盒
【预期用途】
本产品用于体外检测总 PSA 在 4~10 ng/mL(灰度区)的疑似前列腺癌患者 尿液样本中 PCA3 基因及 PSA 基因的表达量,通过计算 PCA3 基因与 PSA 基因 表达量的比值,作为是否需要穿刺活检的辅助诊断指标。
本产品不能单独决定是否需要穿刺活检,临床医生应结合患者的临床表现 和其他实验室检查等指标进行综合分析,做出诊断。本产品不得单独作为疾病 管理决定的依据。
近年来发现的前列腺癌新的标记物 PCA3(Prostate cancer antigen 3),在前 列腺癌中高表达,但在良性前列腺组织、其他类型的正常组织或肿瘤中不表达或 极低表达[1-3] 。PSA 为前列腺特异抗原,PSA 具有组织特异性,只存在于人前列 腺腺泡及导管上皮细胞胞浆中,不表达于其他细胞,但它并无肿瘤特异性[4] 。 PCA3 得分不会因前列腺体积大小而改变,而血清 f/tPSA 却受前列腺增大因素的 影响,在前列腺炎、前列腺增生、尿道感染等非癌性疾病中也会升高[5,6]。
【检验原理】
本试剂盒基于磁珠特异性捕获和一步法 PCR 技术检测原理,定性检测行直 肠指检后尿液中 PCA3 、PSA 基因。
尿液中 PCA3 、PSA mRNA 的提取采用磁珠特异性捕获方法。Oligo d(T) 磁珠特异性结合含 polyA 的捕获探针,同时针对 PCA3、PSA mRNA 基因序列设 计的捕获探针与互补的靶序列特异性结合,从而对靶向基因进行富集提取,避免 非靶标核酸的干扰。其原理示意图如下:
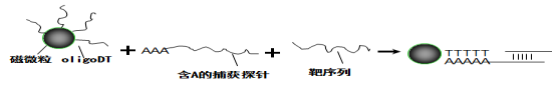
提取后的 RNA 采用一步法进行荧光 PCR 检测,实现 cDNA 合成与PCR 反
应在同反应体系中进行。同时 PCR 反应体系中含有防止 PCR 产物污染的尿嘧啶 -DNA 糖基化酶(UDG),能有效地水解单链或双链 DNA 上的尿嘧啶,从而避免 了 PCR 模板污染导致的假阳性。
检测样本与校准品、阳性质控品、阴性质控品一起进行提取和扩增,通过校 准曲线获得 PCA3 和 PSA 基因的浓度,进而计算出 PCA3 基因与 PSA 基因的比 值得分(Score 值)。
【主要组成成份】
试剂盒由两部分组成,分别为人 PCA3/PSA 基因 mRNA 提取试剂、人 PCA3/PSA 基因检测试剂(详见表 1~2)。
组分 1:人 PCA3/PSA 基因 mRNA 提取试剂
表 1 人 PCA3/PSA 基因mRNA 提取试剂组分
编号 | 组分名称 | 数量 | 规格(12 测 试) | 主要成分 |
1 | PCA3 捕获液 | 1 瓶 | 4.5mL/瓶 | HEPES 、LiCl 、LiOH 、EDTA 、磁 珠、PCA3 捕获探针 |
2 | PSA 捕获液 | 1 瓶 | 4.5mL/瓶 | HEPES 、LiCl 、LiOH 、EDTA 、磁 珠、PSA 捕获探针 |
3 | 漂洗液 | 1 瓶 | 25mL/瓶 | HEPES 、NaCl 、NaOH 、EDTA |
4 | 洗脱液 | 1 管 | 1.5mL/管 | Tris 、HCl |
组分 2:人 PCA3/PSA 基因检测试剂
表 2 人 PCA3/PSA 基因检测试剂
编号 | 组分名称 | 数量 | 规格(12 测试) | 主要成分 |
1 | 2×PCA3 反应 液 | 1 管 | 550μL/管 | Buffer 、PCA3 引物、PCA3 探针及 dNTP |
2 | 2×PSA 反应液 | 1 管 | 550μL/管 | Buffer 、PSA 引物、PSA 探针及 dNTP |
3 | 酶混合液 | 1 管 | 55μL/管 | 逆转录酶、RNase 抑制剂、尿嘧啶-DNA 糖 基化酶、热启动 Taq 酶 |
4 | PCA3 校准品 1 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 1.25×107copies/mL 的体外转录 RNA |
5 | PCA3 校准品 2 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 1.25×106copies/mL 的体外转录 RNA |
6 | PCA3 校准品 3 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 1.25×105copies/mL 的体外转录 RNA |
7 | PCA3 校准品 4 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 1.25×104copies/mL 的体外转录 RNA |
8 | PCA3 校准品 5 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 1.25×103copies/mL 的体外转录 RNA |
9 | PSA 校准品 1 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度 6.25×107copies/mL 的体外转录 RNA |
10 | PSA 校准品 2 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 6.25×106copies/mL 的体外转录 RNA |
11 | PSA 校准品 3 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 6.25×105copies/mL 的体外转录 RNA |
12 | PSA 校准品 4 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 6.25×104copies/mL 的体外转录 RNA |
13 | PSA 校准品 5 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 6.25×103copies/mL 的体外转录 RNA |
14 | 阳性质控品 1 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 1.25×106copies/mL 的体外转录 PCA3 RNA |
15 | 阳性质控品 2 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 6.25×106copies/mL 的体外转录 PSA RNA |
16 | 阴性质控品 1 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 1.25×104copies/mL 的体外转录 PCA3 RNA |
17 | 阴性质控品 2 | 1 管 | 800μL/管 | 1.5%LLS 的 PBS 稀释浓度为 6.25×106copies/mL 的体外转录 PSA RNA |
18 | 纯化水 | 1 管 | 1 mL/管 | 作为 NTC 的模板 |
注:
1 、不同批号试剂盒中各组分不可相互混用。
2 、检测需要但试剂盒中未提供的试剂及耗材如下:
细胞保存液(生产厂家:江苏为真生物医药技术股份有限公司,备案凭证编号:苏苏械备 20151004 号,规格:2.5mL)、磁力架、 1.5mL 离心管、10/100/200/1000mL 移液器及对应 滤芯吸头、八连管及管盖/96 孔 PCR 板。
3 、产品校准品可溯源至 ddPCR 测量程序。
【储存条件及有效期】
1、试剂盒有效期为 12 个月。
人 PCA3/PSA 基因 mRNA 提取试剂(组分 1)于 2~8℃保存。
人 PCA3/PSA 基因检测试剂(组分 2)于-20℃±3℃中保存,其中 2×PCA3 反 应液和 2×PSA 反应液于-20℃±3℃避光保存。
2 、开封后,该试剂盒可在 2~8℃稳定储存不超过 48 小时。
3、请严格按照说明上规定的条件进行保存,冻存试剂避免反复冻融,冻融次数 不得超过 5 次。
4、生产日期及使用期限:见标签。
【适用仪器】
Roche LightCycLer®480 荧光定量 PCR 仪。
【样本要求】
1 、样本类型:尿液。
2 、尿液样本采集及处理
a) 直肠指检:患者在行直肠指检(DRE)前建议先喝 500mL 水,行直肠指 检。指检要求分别自前列腺底部按压腺体(下陷约 1cm)移动至腺体顶部,自左 右两侧向中间移动,每一侧都要轻压 3 次;
b) 收集 DRE 后第一次的尿液的首段至带盖的无菌尿液收集杯中至少 5mL, 最佳采集量为 20-30mL,上下颠倒 5 次摇匀后,尿液采集后应置入下表保存液进 行保存,保存液与尿液大约按 1:1 混合,上下颠倒 5 次混匀后,即为处理后的尿 液样本。
3 、尿液样本的保存
1)不含保护液的尿液在 2-8℃下可短暂保存不超过 4 小时。
2)处理后的尿液样本,应立即提取 RNA 进行检测。如不能立即检测,可 在 2~8℃存放不超过 3 天;在-20℃±3℃保存不超过 12 个月;在-80℃以下保存 不超过 12 个月。处理后的尿液样本避免反复冻融,冻融次数不得超过 5 次。
【检验方法】
1 、mRNA 的提取
1.1 实验前准备:
1)所用吸头、EP 管等耗材均为 RNase-free;
2)检查尿液样本,如为冷藏保存后的样本则需放于 37℃水浴中促溶,如 为新鲜样本,直接使用;
3)检查漂洗液是否有晶体析出,如有使用前需 37℃促溶。
4)取出 PCA3 校准品和质控品、PSA 校准品和质控品于 37℃水浴或金属 浴至完全融化;
5)在 10~30℃下进行操作,过高或过低都影响检测效果。
1.2 提取步骤如下:
1)取 PCA3 校准品 1~5 、阳性质控品 1 和阴性质控品 1 的 EP 管中加入
200μLPCA3 捕获液(磁珠须混匀);取 PSA 校准品 1~5 、阳性质控品2 和阴性 质控品 2 的 EP 管中加入 200μLPSA 捕获液(磁珠须混匀);
2)取 800μL 处理后的尿液样本于 1.5mLEP 管中,每个样本 2 个提取反 应,经短暂离心后,1 管加入 200μLPCA3 捕获液,另 1 管加入 200μLPSA 捕 获液;
3)将 EP 管上下颠倒 8~10 次混匀后,置于 62℃水浴锅或金属浴 10min;
4)取出后上下颠倒 8~10 次混匀后,室温静置40min;
5)短暂离心,磁力架上放约 3min 后吸弃废液,动作缓慢轻柔(注意避免 吸到磁珠,尽量去除残液);
6)加 500μL 的漂洗液,上下颠倒充分混匀,短暂离心,磁力架上放 2min 后吸弃废液,动作缓慢轻柔(注意避免吸到磁珠);
7)立即短暂离心,放磁力架上 1min,用 10μL 小枪头轻柔吸弃残余废液, 充分吸净(注意避免吸到磁珠);
8)每个样本加入 75℃预热的洗脱液(提前 10min 预热)30μL;
9)涡旋混匀,短暂离心,在 75℃水浴2min,涡旋混匀,短暂离心;
10)在磁力架上放置 2min,然后轻柔吸取 25μL 溶液于新的 EP 管中,做 好标记,4℃存放,当天进行 RT-qPCR 检测。如提取的 RNA 不能及时检测,在 4℃下可保存 7 天,在-20℃下可保存 30 天,避免反复冻融,冻融次数不得超过
1 次。
2. 检测
1)将人 PCA3 基因检测试剂置于 2~8℃冰箱中,自然融化,轻弹混匀、瞬 离至管底。
2)按照表 3 的反应体系,配制 PCA3 和 PSA 反应混合液,混匀后分装至 八联管中。
表 3:反应混合液(12 测试)
PCA3:
试剂 | 用量 | 总体积(μL) |
酶混合液 | 1.25μL×1.1×20 | 27.5 |
2×PCA3 反应液 | 25μL×1.1×20 | 550 |
Total | 26.25μL×20 | 525 |
PSA:
试剂 | 用量 | 总体积(μL) |
酶混合液 | 1.25μL×1.1×20 | 27.5 |
2×PSA 反应液 | 25μL×1.1×20 | 550 |
Total | 26.25μL×20 | 525 |
3)根据待测样本数量设计加样布局,推荐布局见表 4。 表 4 排版(12 测试)
| PCA3 检测试剂 | PSA 检测试剂 |
A | PCA3 校准品 1 | 待检样品 1 | 待检样品 9 | PSA 校准品 1 | 待检样品 1 | 待检样品 9 |
B | PCA3 校准品 2 | 待检样品 2 | 待检样品 10 | PSA 校准品 2 | 待检样品 2 | 待检样品 10 |
C | PCA3 校准品 3 | 待检样品 3 | 待检样品 11 | PSA 校准品 3 | 待检样品 3 | 待检样品 11 |
D | PCA3 校准品 4 | 待检样品 4 | 待检样品 12 | PSA 校准品 4 | 待检样品 4 | 待检样品 12 |
E | PCA3 校准品 5 | 待检样品 5 |
| PSA 校准品 5 | 待检样品 5 |
|
F | 阳性质控品 1 | 待检样品 6 |
| 阳性质控品 2 | 待检样品 6 |
|
G | 阴性质控品 1 | 待检样品 7 |
| 阴性质控品 2 | 待检样品 7 |
|
H | 无模板对照 | 待检样品 8 |
| 无模板对照 | 待检样品 8 |
|
4)分别向每个 PCA3 反应孔中加入 26.25μLPCA3 反应混合液;向每个 PSA 反应孔中加入 26.25μLPSA 反应混合液;
5)分别向对应的反应孔中加入各种浓度的校准品、待检样本、阳性质控 品、阴性质控品、无模板(纯化水)对照 24μL,小心盖上八联管管盖。振荡混 匀,离心上机。
6)按照表 5 指示设置反应程序(首次设置程序应保存为模板程序),命名 实验名称并保存,样本上机运行 PCR 反应,并及时根据实验布局分别编辑
PCA3 及 PSA 子集、校准品赋值、加样排版和样本名称。
表 5:反应程序
UDG 酶去污染 | 逆转录 | 预变性 | 扩增 | 冷却 |
37℃ 5min | 50℃ 15min | 94℃ 5min | 94℃,10sec 60℃,30sec 50cycles | } | 50℃,30sec |
荧光设置说明 | 荧光检测通道:FAM; 荧光检测位置:扩增循环中的 60℃末端。 |
3.PCR 结果分析
PCR 运行结束以后,按照以下设置要求,在 LightCycler® 480 基本软件模块 栏中进行分析。
3.1 选择“Analysis Overview”。
3.2 选择“Abs Quant/Fit Points”分析模式。
3.3 选择“Filter Comb 465 – 510”。
3.4 选择“Cycle Range”窗口,设定 “First Cycle” 为 “4” ;“Last Cycle” 为
“50”。
3.5 选择“Noise Band”窗口,将“noise band”设定为”Noise Band (auto)”。
3.6 选择“Analysis”窗口,选择“Threshold (auto)”。除非自动计算异常的情 况下(阈值线超出扩增曲线上方或下方,基线异常等进行手动调整),选择
“Threshold (Manual)”,将“ threshold”设定与Noise Band的值一致。
3.7 点击“Calculate”,样品的PCA3或PSA的拷贝数将会被自动计算。
【阳性判断值】
1. PCA3 Score 的参考值采用 ROC 曲线法制定,为了确定最佳临界点,与临床 诊断金标准结果进行对比,根据约登指数最大原则,确定试剂盒的阳性判断值。 使用统计分析软件,对 212 例总 PSA 为 4~10ng/mL 的疑似前列腺癌临床样本 检测结果进行 ROC 曲线分析,结果显示 cutoff 值为 40.1518 时最优。曲线下面 积 0.8111,检测灵敏度 79.46%,特异性 82.00%。
2. 根据公式计算 PCA3 得分,PCA3 Score= ×1000,与参考
值范围比较。
1)PCA3 score ≤40.1518,检测结果为阴性。
2)PCA3 score >40.1518,检测结果为阳性。
【检验结果的解释】
实验结束以后,按以下步骤进行分析、判定:
1. 运行无模板对照扩增曲线分析,应无扩增曲线升起,说明实验无污染,可以 继续分析;
2. 校准品:PCA3 校准品和 PSA 校准品应均有扩增信号,且呈“S 型”扩增曲线 趋势,且测量 PCA3 和 PSA 校准品线性,其相关系数满足 ︱ r ︱ ≥0.980,可以 继续分析。
3. 质控品:阳性质控品 1 和阳性质控品 2 应均有扩增信号,呈“S 型”扩增曲线 趋势,且 PCA3 score 应>40.1518,为阳性;阴性质控品 1 和阴性质控品 2 应 均有扩增信号,呈“S 型”扩增曲线趋势,且 PCA3 score 应≤40.1518,为阴性, 可以继续分析。
4. 根据检测样本的 PCA3 和 PSA 基因拷贝数,需手动导出数据后,计算 PCA3 score ,根据表 6 进行样本检测结果的判读。
表 6 Score 值处理情况汇总
类别 | PCA3 结果 | PSA 结果 | Score 值 | 处理情况 |
1 | 无扩增/校准范围 内/校准范围外 | 无扩增/校准范 围下限外 | 无效样本 | 可以复检或重新采样 |
2 | 校准范围内 | 校准范围内 | Score 值 | 正常判读阴阳性 |
3 | 校准范围下限外 | 校准范围内 | < (1.25×103copies/ mL/PSA copies/mL) ×1000 | 如 Score 值<阳性判 断值为阴性,如 Score 值>阳性判断 值则判断不出阴阳 性,需复检 |
4 | 校准范围上限外 | 校准范围内 | > (1.25×107copies/ mL/PSA copies/mL) ×1000 | 该情况为>200,即阳性 |
5 | 无扩增 | 校准品范围内/ 校准范围上限外 | Score=0 | 阴性 |
6 | 校准范围内/校准 范围上限外 | 校准范围上限外 | — | 稀释后复检 |
注:临床样本涉及的所有复检都需要重新提取样本 RNA,再进行复检,不可 直接用当次提取的 RNA 进行复检。
【检验方法的局限性】
本试剂盒的检测结果仅供临床参考,对患者的选择应结合其症状/体征、病史、 其他实验室检查及治疗反应等情况综合考虑。
阴性结果不能完全排除前列腺恶性病变的存在,样本中肿瘤细胞过少、核酸 过度降解或扩增反应体系中靶基因浓度低于检测限亦可造成阴性结果。
不合理的样本采集、转运及处理、以及不当的试验操作和实验环境均有可能 导致假阴性或假阳性结果。
【产品性能指标】
1. 外观和性状
1)试剂盒各组分应齐全、完整、液体无渗漏。
2)试剂盒组分 1 中的捕获液均为土黄色液体,静置后土黄色沉淀于底部;组 分 2 中除 2×PCA3 反应液,2×PSA 反应液为红色澄清液体,其余试剂应均为无 沉淀、无悬浮物、无絮状物的澄清液体。
3)中文包装、标签应清晰,准确、牢固。
2. 提取效率
1)对强阳性提取参考品进行提取,经 PCR 检测后,结果 PCA3 Score 值应为 阳性;
2)对弱阳性提取参考品进行提取,经 PCR 检测后,结果 PCA3 Score 值应为 阳性。
3. 准确度
检测准确度参考品,PCA3 Score 值阳性符合率 100%。
4. 特异性
1)检测特异性参考品,PCA3 Score 值阴性符合率 100%。
2)PCA3 试剂检测 PCA3 交叉特异性参考品,结果应为 PCA3 无扩增。
3)PSA 试剂检测 PSA 交叉特异性参考品,结果应为 PSA 无扩增。
5. 精密度
1)检测精密度参考品检测浓度对数值的变异系数均满足(CV ,%)≤ 5%;
2)PCA3 Score 值的变异系数均满足(CV ,%) ≤ 20%。
6. 检出限
PCA3 检出限不高于 1000 copies/mL;PSA 检测限不高于 6000copies/mL。
7. 交叉与干扰:
1)交叉反应:本产品与白色念珠菌、大肠杆菌、肺炎克雷伯菌、奇异变形杆 菌、假单胞菌、金黄色葡萄球菌、非目标 PCA3 RNA 无交叉反应。
2)干扰试验:样本中可能存在的干扰物质:白蛋白(≤ 60g/L)、未结合胆红
素(≤ 342μmol/L)、胆固醇(≤ 13mmol/L)、葡萄糖(≤ 55mmol/L)、血红蛋白 (≤ 2g/L)、免疫球蛋白 G (≤ 32mg/L)、甘油三酸脂(≤ 37mmol/L)、尿酸(≤ 1.4mmol/L)、红细胞(≤ 5.10×107cell/L)、白细胞(≤ 7.60×107cell/L)、对乙 酰氨基酚(≤ 1.324mmol/L)、乙酰水杨酸(≤ 3.62mmol/L)、阿呋唑嗪(≤ 30mg/L)、
别嘌呤醇(≤ 0.294μmol/L)、氨氯地平(≤ 0.245μmol/L)、阿替洛尔(≤ 37.6μmol/L)、
阿托伐他汀(≤ 25mg/L)、环丙沙星(≤ 30.2μmol/L)、苯海拉明(≤ 19.6pmol/L)、
度他雄胺(≤ 1.5mg/L)、非那雄胺(≤ 15mg/L)、氟西汀(≤11.2μmol/L)、氟他 胺(≤ 2.25g/L)、呋喃苯胺酸(≤0.181mmol/L)、布洛芬(≤ 2.425mmol/L)、左 氧氟沙星(≤ 48.6μmol/L)、赖诺普利(≤ 0.74pmol/L)、盐酸二甲双胍(≤ 0.31mmol/L)、 硒(≤ 1mg/L)、西地那非(≤ 12.9nmol/L)、坦索罗辛(≤ 1.2μg/L)、特拉唑嗪 (≤ 7.8μmol/L)、钙(≤ 5mmol/L)、多沙唑嗪(≤ 1.33pmol/L)、强力霉素(≤ 1.35pmol/L)、呋磺胺(≤ 0.181mmol/L)、锯棕榈(≤ 11.25g/L)、柳氮磺胺吡啶 (≤ 0.754mmol/L)对试剂的检测结果无干扰。
8.临床评价:
本产品在四家临床试验机构进行临床试验,共前瞻性入组 556 例疑似前列腺 癌患者,主要包括 tPSA 位于4~10 ng/mL(灰度区)的疑似前列腺癌患者。采用 本产品与临床参考标准进行比较研究,同时进行临床常规使用的游离 PSA 与总 PSA 比值(fPSA/tPSA)与临床参考标准的比较研究,并进一步比较本产品与 fPSA/tPSA 的临床性能,从而确认本产品的预期用途。其中, 临床参考标准采用 前列腺穿刺活检病理结果。试验结果显示,针对 tPSA 位于 4~10 ng/mL(灰度区) 的疑似前列腺癌患者,本产品的临床灵敏度 79.1%,临床特异度为 83.1%,总符 合率为 81.6%,阳性预测值为 75%,阴性预测值为 86.1% 。fPSA/tPSA 与临床参 考标准比较的临床灵敏度 64.8%,临床特异度为 76.1%,总符合率为 71.7%,阳 性预测值为 63.4%,阴性预测值为 77.1%。
【注意事项】
1 .本试剂盒检测目标基因主要位于尿液脱落细胞中,尿液样本的采集和处理须 严格按照说明书步骤进行,不规范的样本采集和处理方式将会影响检测结果的准 确性。
2 .应由具备专业经验或经培训合格的人员进行操作。
3 .检测结果会受到样品本身的来源、样品采集过程、样品质量、样品运输条 件、样品预处理等因素影响,同时也受到RNA提取质量、荧光定量PCR仪型
号、操作环境以及当前分子生物学技术的局限性等限制,由此,可能导致极少 数样品得出假阳性或假阴性的检测结果。使用者须了解检测过程中可能存在的 潜在错误、准确性的局限性。
4 .应该严格区分阳性质控品和反应试剂的使用,防止污染试剂,造成假阳性。
5 .本试剂盒所有试剂均经过特别配制,以用于上述检测。随意替换试剂盒中的 任何试剂,都可能影响使用效果。不同批号试剂盒成分不可相互混用。
6 .试验时注意防止外源RNA对试剂的污染,注意先加完样品RNA后再在进行 阳性质控品的操作。推荐在制备反应试剂和添加RNA模板时,使用单独、专用 的移液器和滤芯枪头。进行反应试剂制备的地点应当与添加模板的地点相隔
离。
7 .试验室应按试剂准备区、样品处理区、反应液配置区、扩增检测分析区分隔 使用。操作过程应工作服、帽、鞋、手套等穿戴齐全,各区物品均为专用,不 得交叉使用,避免污染。
8 .反应液分装时应尽量避免产生气泡,并注意防止泄漏,以免荧光物质污染仪 器。
9 .为避免污染,试验开始前应用 10%次氯酸钠和 75%酒精擦拭核酸提取台面、 超净工作台、移液器等, 紫外消毒 15 分钟后开无菌风吹 15 分钟后开始操作。试
验过程中若出现样品及试剂污染工作台及移液器,应及时用 10%次氯酸钠或 75% 酒精处理。试验结束后应立即清洁工作台,10%次氯酸钠和 75%酒精擦拭台面,
移液器等,紫外消毒 15 分钟后开无菌风吹 15 分钟。
10 .不要使用超过有效期的试剂。
11 .临床实验室应严格按照《医疗机构临床基因扩增实验室管理办法》(卫办医 政发〔2010〕194 号)等有关分子生物学实验室、临床基因扩增实验室的管理规
范执行。
【参考文献】
[1] Bussemakers M J G , BokhovenAV , Verhaegh G W , et al. DD3: Anew prostate- specific gene, highly overexpressed in prostate cancer[J]. Cancer Research, 2000, 59(23):5975-5979.
[2] de Kok JB; Verhaegh GW; Roelofs RW; Hessels D; Kiemeney LA; Aalders TW; Swinkels DW; SchalkenJA. DD3(PCA3), a very sensitive and specific marker to detect prostate tumors.[J]. Cancer Research, 2002, 62(9):2695-2698.
[3] Black D L . Mechanisms of Alternative Pre-Messenger RNA Splicing[J]. Annual Review of Biochemistry, 2003, 72(1):291-336.
[4] Polascik TJ, Oesterling JE, Partin AW. Prostate specific antigen: a decade of discovery-what we have learned and where we are going. JUrol 1999;162:293-306.
[5] 顿耀军,徐涛. 前列腺癌早期诊断相关标志物的研究进展[J]. 现代泌尿外科 杂志, 2016 年(21):393-396.
[6] Sinan A, Efe O,et al.Free prostate-specific antigen outperforms total prostate- specific antigen as a predictor of prostate volume in patients without prostate cancer.
Archivio Italiano di Urologia e Andrologia 2020; 92, 1.
【基本信息】
注册人/生产企业名称:江苏为真生物医药技术股份有限公司
住 所:苏州市工业园区星湖街 218 号生物纳米园 C4 楼 201 、301 室 联系方式:
售后服务单位名称: 联系方式:
生产地址:苏州工业园区金鸡湖大道 99 号纳米城西北区 16 栋 2 层,苏州市工业
园区星湖街 218 号生物纳米园 C4 楼 201 、301 室 生产许可证编号:
【医疗器械注册证编号/产品技术要求编号】
【说明书核准日期及修改日期】
